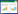文章信息
- 胡岚岚, 汤建林, 周世文, 徐颖, 张玥
- HU Lan-lan, TANG Jian-lin, ZHOU Shi-wen, XU Ying, ZHANG Yue
- UPLC-MS/MS测定人血浆中罗红霉素的浓度及在药代动力学中的应用
- Quantification of roxithromycin in human plasma by UPLC-MS/MS and its application in a pharmacokinetic study
- 中国测试, 2013, 39(6): 60-63,103
- CHINA MEASUREMENT & TEST, 2013, 39(6): 60-63,103
- 10.11857/j.issn.1674-5124.2013.06.017
-
文章历史
- 收稿日期: 2013-06-05
- 收到修改稿日期: 2013-09-25
UPLC-MS/MS测定人血浆中罗红霉素的浓度及在药代动力学中的应用
第三军医大学新桥医院临床药理基地, 重庆 400037
摘要: 建立一种快速、准确测定人血浆中罗红霉素浓度的UPLC-MS/MS分析方法。以克拉霉素为内标,0.2 mL含药血浆经碱化、乙酸乙酯萃取后进样分析;色谱柱为Acquity UPLC BEH C18(2.1 mm×50 mm×1.7 μm),流动相组成为乙腈:0.01%醋酸铵=30:70,梯度洗脱方式,乙腈比例在4 min内从30%变为70%,流速0.3 mL/min,柱温为35℃,进样量3 μL。质谱条件:气动辅助电喷雾离子化(ESI)源;正离子检测(MRM)模式,罗红霉素质荷比为(m/z 837.53→m/z 158.15)和克拉霉素质荷比为(m/z 748.48→m/z 590.30)。罗红霉素在0.05~25.6 μg/mL的浓度范围内呈线性,定量下限为0.05 μg/mL,基质效应影响小,日内变异系数小于10.3%,日间变异系数小于9.4%,相对回收率在97.5%~106.4%之间。该方法准确、快速、灵敏,可用于微量血浆的罗红霉素药物浓度监测、人体内药代动力学及生物等效性研究。
关键词:
罗红霉素
UPLC-MS/MS
药代动力学
血浆
Quantification of roxithromycin in human plasma by UPLC-MS/MS and its application in a pharmacokinetic study
Base for Drug Clinical Trial, Xinqiao Hospital, Third Military Medical University, Chongqing 400037, China
Abstract: To establish a rapid and accurate method for quantification of roxithromycin in human plasma with UPLC-MS/MS, human plasma sample was alkalized by sodium carbonate, extracted with ethyl acetate, the roxithromycin and internal standard clarithromycine were separated on an acquity UPLC BEH C18 column (2.1 mm×50 mm× 1.7 μm) using gradient elution with acetonitrile (mobile phase A) and 0.01% ammonium acetate (mobile phase B) with a flow rate of 0.3 mL/min and a total runtime of 4.0 min. Mass spectrometry: The analytes were detected by the electronic-spryionization (ESI), selected multiple reaction monitoring (MRM) using the precursor to product ion combinations of m/z 837.53→158.15 and m/z 748.48→590.30 was performed to detect roxithromycin and the internal standard respectively. The method was linear over the concentration range of 0.05-25.6 μg/mL. The lower limit of quantification was 0.05 μg/mL. Intra-day inaccuracy was within 10.3% and inter-day was less than 9.4%. Matrix effects were minor. The recovery of the method was between 97.5% and 106.4%. The validated method was developed for quantification of roxithromycin in small volumes of plasma. The method can be used for therapeutic drug monitoring and the study of pharmacokinetics and bioavailability of roxithromycin.
Key words:
roxithromycin
UPLC-MS/MS
pharmacokinetics
plasma
0 引 言 0 引 言
罗红霉素(roxithromycin)是20世纪80年代初开发的十四元环口服用大环内酯类抗生素。它是红霉素衍生物,在抗菌活性与生物利用度方面较其他红霉素衍生物强,临床主要适应症为敏感菌所致的五官、呼吸道及皮肤感染等。
目前测定罗红霉素血药浓度的方法较多,主要有高效液相色谱法和液质联用法。这些方法中,液相色谱-紫外检测法(HPLC-UV)[1, 2, 3]进样时间长,试剂损耗大,而且罗红霉素在近紫外端210 nm处有最大吸收,内源性物质易出现干扰;电化学法[4]对温度的改变较敏感,若控制不好,对峰形和灵敏度都有影响,且血浆处理过程较繁琐;高效液相色谱-蒸发光检测器法(HPLC-ELSD)[5]具有基线噪音小的优点,但是灵敏度低,不适用于微量血浆样品的药物浓度测定;液相色谱-质谱联用法(LC-MS)[6, 7]相对来说灵敏度与选择性较高,但是仍存在分析时间长的问题。与传统LC-MS法比较,本文建立的超高效液相色谱-串联质谱(UPLC-MS/MS)法出峰速度是HPLC[6]的3倍,能够对大批量样品进行快速分析。超高效液相色谱是采用新型全多孔球形1.7 μm反相固定相,它更耐高压(达15000Psi),并且该体系进样体积小(3 μL),减少了交叉污染[8]。因此,使用本方法在缩短了样品分析时间的同时,大大减少了溶剂使用量,使方法更为经济和环保。所建方法可用于微量血浆的罗红霉素药物浓度监测,及其人体内药代动力学及生物等效性研究。
1 实验部分
1.1 仪器与试剂
Waters-Acquity型超高效液相色谱质谱系统 (配QBA235型TQ检测器,K07UPA 468M型Sample Manager,K07UP8 450M型Binay solvent Manager及Masslynx v4.1色谱管理软件,Waters公司);色谱柱:Acquity UPLC BEH C18(2.1 mm×50 mm×1.7 μm);MC-210S型电子天平(准确度0.01 mg,Sartorius公司);Abbott Diagnostics,Division离心机(made in west Germany);XH-86多用途旋涡混合器(江苏阜宁县罗桥校办工厂),Millipore超纯水系统。对照品:罗红霉素对照药(批号:130557-200502,含量94.1%,中国药品生物制品检定所),克拉霉素内标物(含量≥97.5%,批号:130558-200501,中国药品生物制品检定所),乙腈、甲醇均为色谱纯(Burdick&Jackson公司);醋酸铵(纯度≥99.0%,天津市光复精细化工研究所),试验用水均为Millipore超纯水。
1.2 实验方法
1.2.1 流动相的配制
精密称取0.385 g醋酸铵于500 mL容量瓶中,用超纯水定容,即得0.01 mol/L溶液,经0.45 μm的水性滤膜过滤后于室温保存即可。
1.2.2 标准溶液的配制
精密称取10.21 mg罗红霉素与5.10 mg克拉霉素,分别用乙腈和50%甲醇溶解并定容于50 mL容量瓶中,配成浓度为204.8 μg/mL的罗红霉素和100.0 μg/mL克拉霉素储备液,4 ℃冰箱保存备用。取其储备液用乙腈对半稀释至浓度分别为25.6,12.8,6.4,3.2,1.6,0.8,0.4,0.2,0.1,0.05 μg/mL的标准工作液,4 ℃冰箱保存备用。将克拉霉素标准储备液稀释至浓度为25 μg/mL的工作液,4 ℃冰箱保存备用。
1.2.3 血浆样品的处理
精密移取0.2 mL空白血浆于1.5 mL离心管中,加入内标溶液(25.0 μg/mL)50 μL,混旋1 min,加碳酸钠(0.05 mol/mL)100 μL混匀2 min后,加乙酸乙酯500 μL混匀10 min,离心5 min,取上清液用氮气吹干后,加500 μL流动相复溶,再次离心5 min,取上清液经0.22 μm的滤膜过滤后进样。
1.2.4 色谱条件
采用Acquity UPLC BEH C18(2.1 mm×50 mm×1.7 μm)分析柱;流动相:乙腈+0.01%醋酸铵;梯度法洗脱:乙腈与0.01%醋酸铵之比在0~4 min内由30∶70递增至70∶30;流速为0.3 mL/min,柱温为35 ℃,进样量为3 μL。
质谱条件:气动辅助电喷雾离子化(ESI);多反应监测(MRM);罗红霉素:[M+H]离子m/z 837.53,碎片子离子m/z 158.15,碰撞电压30 V,毛细管电压3.5 kV,锥孔电压40 V。内标:克拉霉素[M+H]离子m/z 748.48,碎片子离子m/z 590.30,碰撞能量40 V,毛细管电压3.5 kV;锥孔电压40 V。脱溶剂温度:350 ℃;离子源温度:120 ℃;脱溶剂气流:600 L/h;锥孔气流:50 L/h。
1.2.5 方法验证
本文对UPLC-MS/MS方法进行了线性、定量下限(LLOQ)、精密度、回收率、稳定性及基质效应的验证。
1.2.6 研究方案设计
健康男性受试者20名:年龄18~40周岁(22.65±1.35岁);体重62~76 kg(62.35±6.50 kg),口服罗红霉素参比制剂300 mg,于给药前和后0.33,0.67,1,1.5,2,3,4,6,8,12,24,36,48 h抽取上肢静脉血,分离血浆,以克拉霉素为内标,UPLC-MS/MS测定人血浆中罗红霉素浓度,所得数据经处理后统计分析。本实验遵循药品临床试验管理规范(GCP)指导原则进行,试验方案经第三军医大学第二附属医院医学伦理委员会批准通过。
2 结果与讨论
2.1 分离特异性
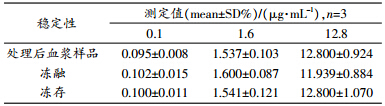
在上述色谱条件和质谱条件下,测得罗红霉素和内标克拉霉素质谱图分别如图 1和图 2所示。由图可见,待测物与内标物两者峰形良好,血样中罗红霉素和克拉霉素的保留时间分别为1.97 min和1.90 min。
2.2 标准曲线和线性范围
取上述配置好的工作液50 μL于1.5 mL离心管中氮吹挥干,加入内标溶液(25.00 μg/mL)50 μL,空白血浆200 μL后按血浆处理方法配制成血浆浓度为:25.6,12.8,6.4,3.2,1.6,0.8,0.4,0.2,0.1,0.05 μg/mL的溶液进样分析,每个浓度平行两份。按“1.2.3血浆样品处理”项下依法操作,每一浓度进样3 μL。记录质谱图,以浓度为横坐标,以克拉霉素与内标峰峰面积比为纵坐标进行线性回归,得回归方程:Y=3.921X-0.096 4(r=0.998 7,leve1=10,n=2,各点RSD<15%),线性范围为0.05~25.6 μg/mL,血浆中罗红霉素定量下限为0.05 μg/mL(S/N=10,x=0.06±0.004,RSD=6.80%,n=5)。
2.3 基质效应
本文采用“提取后加入法”对罗红霉素进行基质效应的评价[9, 10, 11]。配制0.1 μg/mL罗红霉素标准工作液及5 μg/mL内标克拉霉素各3份,7个不同来源的罗红霉素血浆生物样品(0.1 μg/mL)及7个不同来源的克拉霉素血浆生物样品(5 μg/mL)各3份,进样分析,测其峰面积,用生物样品的峰面积与标准工作液的峰面积的比值来计算基质效应相对响应值及变异系数。结果待测物罗红霉素的基质效应分别为102.2%,107.9%,103.2%,94.2%,103.1%,109.9%,113.7%,变异系数为6.0%。内标克拉霉素的基质效应分别为110.1%,112.0%,108.9%,112.0%,109.4%,110.3%,111.6%,变异系数为1.1%。均满足试验要求。
2.4 回收率试验
2.4.1 相对回收率试验
配制0.1,1.6,12.8 μg/mL罗红霉素血样各6份,按照“1.2.3血浆样品处理”项下依法操作,进样分析,计算出低、中、高3种浓度罗红霉素的相对回收率(n=6)分别为97.5%,105.7%,106.4%;变异系数分别为8.6%,10.2%,3.9%。结果表明,低、中、高3种浓度的相对回收率均符合要求,方法准确可靠。
2.4.2 萃取回收率试验
配制0.04,0.64,5.12 μg/mL罗红霉素标准工作液及2.50 μg/mL的内标工作液各6份,进样分析,测其峰面积,以对应血浆药物浓度峰面积值除以标准溶液峰面积平均值计算得萃取回收率,结果低、中、高3种浓度的罗红霉素的萃取回收率(n=6)分别为95.8%,85.1%,80.8%;变异系数分别为2.8%,10.0%,4.0%;内标的萃取回收率(n=6)为79.6%,变异系数为4.0%。结果表明,低、中、高3种浓度的萃取回收率均符合要求,方法准确可靠。
2.5 精密度试验
配制0.1,1.6、12.8 μg/mL罗红霉素血样各6份,按照“1.2.3血浆样品处理”项下依法操作,在1 d内不同时间处理测定,考察日内精密度;连续3 d于同一时间配制0.1,1.6,12.8 μg/mL罗红霉素血样各6份,处理测定,考察日间精密度。结果见表 1。
2.6 稳定性试验
2.6.1 血浆样品处理后室温放置的稳定性
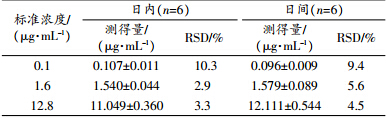
配制0.1,1.6,12.8 μg/mL罗红霉素血样各24份,-80 ℃冰箱放置冻存,按照“1.2.3血浆样品处理”项下依法操作,于0,1,2,3,6,12,24,48 h测定,每个浓度平行3份。考察血浆样品处理后室温放置的稳定性,其结果见表 2。由表可见,血浆样品可于室温下至少保存48 h(RSD<8.4%)。
2.6.2 冻融稳定性
配制0.1,1.6,12.8 μg/mL罗红霉素血样各3份,-80 ℃冰箱放置冻存,然后在室温融化,融化后的样品在同样条件下重新冷冻。按照“1.2.3血浆样品处理”项下依法操作,于每个冻融循环测定,每个浓度平行3份。考察3次冻融循环血样的稳定性,其结果见表 2。由表可见,血浆样品冻融3次仍稳定(RSD<14.7%)。
2.6.3 血浆样品冰箱冻存的长期稳定性
配制0.1,1.6,12.8 μg/mL罗红霉素血样各24份,-80 ℃冰箱放置冻存,按照“1.2.3血浆样品处理”项下依法操作,于0,1,3,5,7,14,21,30 d测定,每个浓度平行3份。考察血浆样品长期冻存的稳定性,其结果见表 2。由表可见,血浆样品可于-80 ℃冰箱至少保存30 d(RSD<11.0%)。
2.7 实测样品结果
20名健康受试者口服300 mg参比制剂罗红霉素胶囊后的血浆样品分6个批次测定。每批随行标准曲线和质控样品27个(低、中、高浓度质控样品各9个),质控样品均匀分布。平均血药浓度-时间曲线图见图 3,主要药动学参数见表 3。
2.8 讨 论
目前应用广泛的血浆处理方法有有机溶剂沉淀蛋白法、液液萃取法(LLE)和固相萃取法(SPE)。在方法特异性实验中,发现不同的血浆处理方法对待测物的干扰有一定差异。分别考察了4种血浆处理方法对待测物的干扰大小,包括碱化后用乙酸乙酯萃取、碱化后用乙醚萃取、乙腈除蛋白法、丙酮除蛋白法。以总离子流数(峰值信号强度)为干扰评价指标,4种方法中,采用乙腈、丙酮直接沉淀蛋白法处理血浆,基质干扰较液液萃取要高,而用乙酸乙酯作萃取剂效果优于乙醚,基质干扰最小。结果,采用的是LLE法进行血浆处理。虽然有机溶剂除蛋白方法简单易行[6, 7],但是在实验过程中,此法不能有效的除去血浆样品的杂质,与液液萃取法相比,该法对待测物的干扰相对较高。
3 结束语
本实验建立了一种快速、灵敏的UPLC-MS/MS 方法来测定人血浆中罗红霉素,该方法采用了一个性能优越的仪器,由于其高效专用的色谱柱使得出峰时间在2 min内完成。除此之外,在分离特异性的基础上,本实验完成了基质效应的考察,从而进一步提高了分析检测结果的准确度和精密度。由试验结果表明,本法简便易行、灵敏度较高、重现性好,生物样本中内源性杂质对测定不产生干扰,可用于该药的生物样本中含量的测定。
 |
| 图 1 各样品的罗红霉素UPLC-MS总离子流图 |
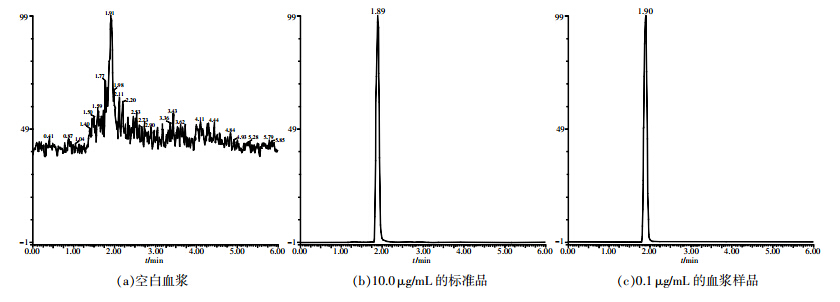 |
| 图 2 各样品的内标克拉霉素UPLC-MS总离子流图 |
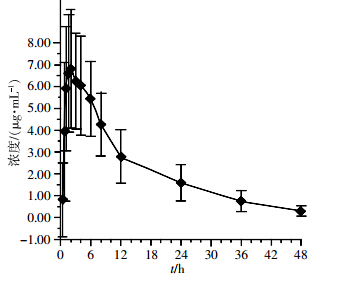 |
| 图 3 20名健康受试者分别口服300 mg参比制剂后 |
参考文献
| [1] | Glowka F K, Karazniewicz-Lada M. Determination of roxithromycin in human plasma by HPLC with fluorescence and UV absorbance detection Application to a pharmacokinetic study[J]. Journal of Chromatography B,2007,852(1-2): 669-673. |
| [2] | Macek J, Ptacek P, Klima J. Determination of roxithromycin in human plasma by high-performance liquid chromatographywith spectrophotometric detector[J]. Journal of Chromatography B,1999,723(1-2):233-238. |
| [3] | Nilsen O G, Aamo T, Zahlsen K. Macrolide pharmaco-kinetics and dose scheduling of ro xithromycin[J]. Diagnostic Microbiology and Infectious Disease,1992,15(4):71-76. |
| [4] | Pappa-Louisi A, Papageorgiou A, Zitrou A,et al. Study on the electrochemical detection of the macrolide antibiotics clarithromycin and roxithromycin in reversed-phase high-performance liquid chromatography[J]. Journal of Chromatography B,2001,755(1-2):57-64. |
| [5] | 陈乃江,张宏. HPLC-ELSD法测定罗红霉素的含量[J].中国抗生素杂志,2009,34(5):288-290. |
| [6] | Hang T J, Zhang M, Song M, et al. Simultaneous determination and pharmacokinetic study of roxithromycin and ambroxol hydrochloride in human plasma by LC-MS/MS[J]. Clinica Chimica Acta,2007,382(1-2):20-24. |
| [7] | 邹健军,彭向东,李兵,等. 人血浆中罗红霉素的HPLC-MS测定及生物等效性研究[J]. 中南药学,2004,2(4):214-216. |
| [8] | Novakova L,Matysova L,Solich P.Advantages of application of UPLC in pharmaceutical analysis[J]. Talanta,2006, 68(3):908-918. |
| [9] | Matuszewski B K, Constanzer M L, Chavez-Eng C M. Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J]. Analytical Chemistry,2003,75(13):3019-3030. |
| [10] | Center D, Evaluation Research. Bioanalytical method validation[Z]. Rockville,MD,USA:Food and Drug Admi-nistration,2001. |
| [11] | Bonfiglio R, King R C, Olah T V, et al. The effects of sample preparation methods on the variability of the electrospray ionization response for model drug compou-nds[J]. Rapid Communications in Mass Spectrometry,1999,13(12):: 1175-1185. |
 2013, Vol. 39
2013, Vol. 39