文章信息
- 袁欣, 苟在旭, 郭琦, 周玉, 贺字英, 方玉宇, 江雪, 黄科
- YUAN Xin, GOU Zaixu, GUO Qi, ZHOU Yu, HE Ziying, FANG Yuyu, JIANG Xue, HUANG Ke
- 基于磁性纳米材料富集-氢化物发生-原子荧光光谱法测定砷的方法研究
- Study on determination of arsenic by hydride generation-atomic fluorescence spectrometry using Fe3O4 magnetic nanoparticles for preconcentration
- 中国测试, 2018, 44(9): 51-56
- CHINA MEASUREMENT & TEST, 2018, 44(9): 51-56
- http://dx.doi.org/10.11857/j.issn.1674-5124.2018.09.010
-
文章历史
- 收稿日期: 2018-02-07
- 收到修改稿日期: 2018-03-16
2. 四川师范大学化学与材料科学学院,四川 成都 610068
2. College of Chemistry and Materials Science, Sichuan Normal University, Chengdu 610068, China
砷是一种常见元素,砷及其化合物由于其极强的生物毒性而受到广泛关注[1-2]。通常,砷在生物体内的含量极低[3-4],在对生物体内砷的检测中,传统的检测方法,如原子荧光光谱法[5-6]、原子吸收光谱法[7]以及原子发射光谱法[8]均存在一定的局限性。其原因一方面是由于传统方法的灵敏度往往不足以对生物体内痕量乃至超痕量的砷进行准确分析;另一方面,复杂的生物基体带来的基体干扰也会影响原子光谱法测定结果的准确性[9]。因此,建立有效的分离富集技术对于生物样品中砷的检测具有重要意义。
目前常用的金属元素分离富集方法有萃取法[10](包括固相(微)萃取[11]、液液(微)萃取[12]、超零界流体萃取[13]、浊点萃取[14]等)、吸附法[15]、离子交换法[16]、磁性分离[17-18]等。其中,基于纳米材料的磁性分离富集方法由于其操作简单、效率高、价格低廉等,已广泛用于重金属、有机污染物、蛋白质及DNA等分析之中[19]。
本工作首次将四氧化三铁磁性纳米材料(Fe3O4 MNPs)用于细胞中痕量砷的快速分离富集。Fe3O4 MNPs具有制备工艺简单、磁性能好以及表面易修饰等优点[13-15]。实验中Fe3O4 MNPs采用共沉淀法低温合成,实验结果表明,该纳米材料对细胞溶液中无机砷的富集效率可达90%以上。富集完成后通过外加磁场即可实现砷和基体的有效分离,分离后的砷溶液通过氢化物发生-原子荧光光谱法进行检测。
1 实验部分 1.1 仪器、试剂与材料实验采用AFS2200双通道原子荧光光谱仪(北京瑞利仪器有限公司),断续流动装置,砷高强度空心阴极灯;80-2B台式离心机(湖南星海仪器有限公司);KQ-80TDB超声仪(昆山市超声仪器有限公司)。实验用Quanta 250扫描电子显微镜(美国FEI公司)观测Fe3O4 MNPs的微观形貌。使用XD-2 X射线衍射仪(北京普析通用)对Fe3O4 MNPs晶相进行表征。
本实验用到的试剂包括硝酸、盐酸、氢氧化钾、硼氢化钾、氯化铁、氯化亚铁、氨水,纯度均为分析纯(成都科龙化工试剂厂)。实验所用的标准物质包括:As3+、Pb2+、Cd2+、Cr3+、Cu2+、Zn2+、Ni2+、Na+、K+和Ca2+的标准储备液,浓度均为1 000 μg/mL,购自国家标准物质研究中心。所有的标准储备液均在4 ℃环境下避光保存,各元素不同浓度标准溶液均由标准储备液稀释而来。实验用水均为超纯水(18.2 MΩ·cm)。
1.2 样品处理实验所用的模拟天然水砷标准溶液(GBW08605)购自国家标准物质中心。除了检测国标样品之外,还分别收集了3种环境水样及2种细胞样品用于实验测定。环境水样采集于成都市内3条河流。采集后均通过0.45 µm滤膜过滤备用。实验所用到的草履虫及巨噬细胞样品购于西南交通大学,细胞均经过含砷溶液培养,其具体处理过程为[16]:向草履虫、巨噬细胞中加入1 μg/mL As(III),在30 ℃下孵化4 h后用50 µm孔径尼龙网将细胞分离出来。分离出的细胞用二次水洗涤三次后备用。取500 µL细胞样品于石英瓶,超声30 min以破碎细胞壁使As(III)释放出来便于分析。
1.3 Fe3O4 MNPs合成方法实验所用Fe3O4 MNPs由共沉淀法制备得到[17]。具体操作步骤为:首先向250 mL三口烧瓶中加入FeCl3 (1 mol/L,50 mL)和FeCl2 (2 mol/L,10 mL),混合均匀后通入N2 30 min以除去溶液中的氧。然后向混合溶液中逐渐滴入氨水(0.7 mol/L,50 mL),机械搅拌30 min得到Fe3O4磁性纳米材料。反应产物Fe3O4 MNPs在外加磁场作用下与母液分离,并用二次水洗涤3次。最后将Fe3O4 MNPs于40 ℃下真空干燥24 h备用。
1.4 分析过程本实验分析过程如图1所示:取待测样品50 mL于烧杯中,加入2.5 g硫脲/抗坏血酸作为预还原剂,将样品中可能存在的As(V)还原为As(III)。调节溶液pH=1(用1 mol/L盐酸和氢氧化钠溶液进行调节),加入2 g/L的Fe3O4 MNPs以吸附其中的As(III),吸附时间为20 min。吸附完成后用磁铁将Fe3O4 MNPs与溶液分离,弃去母液。分离出的Fe3O4 MNPs用去离子水洗涤3次,用5%盐酸溶解其吸附的砷,并用容量瓶定容至1 mL。将制备好的待测溶液与3% (m/v) KBH4混合以产生目标元素的氢化物,在载气Ar和5% HCl载流的作用下进入气液分离器,气态氢化物与液相迅速分离后,进入AFS进行分析测定。氢化物发生反应及AFS的最佳实验条件如表1所示。
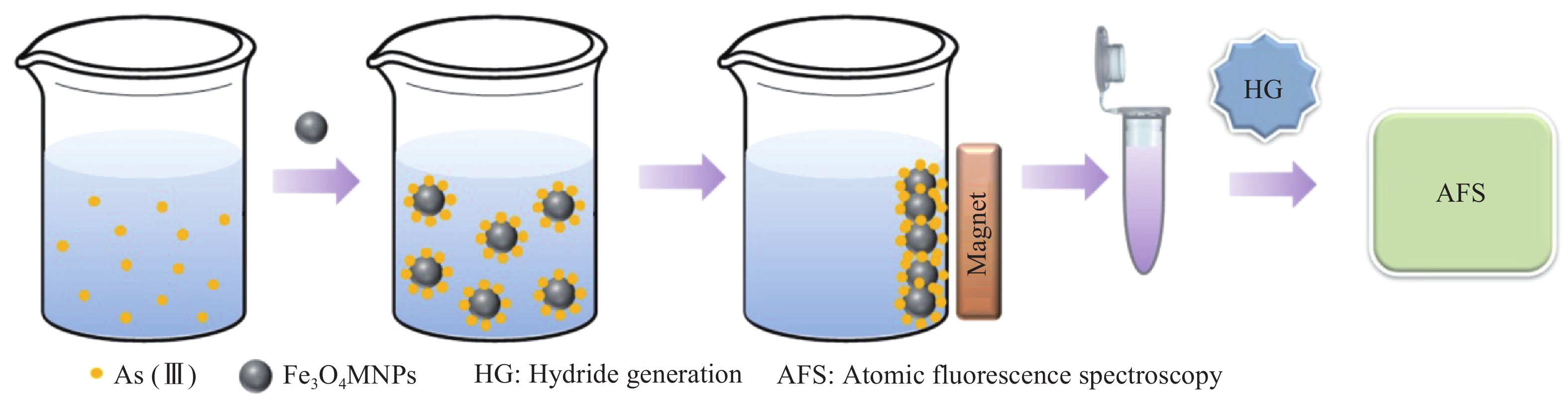
|
| 图 1 分析流程示意图 |
| HCl浓度(v/v)/% | 5 |
| KBH4浓度 (m/v)/% | 3 |
| KOH浓度 (m/v)/% | 0.5 |
| 载气流速/(mL∙min–1) | 500 |
| 砷空心阴极灯/nm | 197.2 |
| 灯电流/mA | 70 |
| 灯电压/V | 300 |
| 原子化器高度/mm | 8 |
| 屏蔽气流速/(mL∙min–1) | 1 000 |
| 测量模式 | 峰面积 |
2 结果与讨论 2.1 纳米材料表征
采用扫描电子显微镜对样品的形貌进行观测,结果如图2(a)所示。从图中可以看出Fe3O4 MNPs为无定型。Fe3O4 MNPs的XRD谱图如图2(b)所示,在30°、35°、43°等处有明显的衍射峰,查阅PDF卡片(JCPDS No. 65-3107)可知衍射峰分别对应于晶体的(220)、(311)和(100)晶面。

|
| 图 2 Fe3O4 MNPs的表征图谱 |
2.2 实验条件优化 2.2.1 pH对吸附效率的影响考察
pH是影响Fe3O4 MNPs对As(III)吸附效率的重要因素,本实验选择优化的pH范围为1.0~12.0。实验结果如图3所示:在强酸性条件下,Fe3O4 MNPs对As(III) 具有较高的吸附效率(>90%),且随pH变化吸附率保持稳定;但随着pH值的继续增大,Fe3O4 MNPs的附效率呈现下降趋势,这可能是由于As(III)在碱性条件下易水解从而降低了Fe3O4 MNPs对其的吸附效率。因此实验最终选择pH=1作为最佳的pH条件。

|
| 图 3 吸附效率随溶液pH值变化曲线 |
2.2.2 吸附时间考察
Fe3O4 MNPs对As(III)的吸附时间同样对吸附效率具有显著影响。吸附效率随时间的变化曲线如图4所示,当吸附时间从0增加到20 min时,吸附效率逐渐上升。20 min之后继续增加吸附时间,吸附效率则保持不变。因此,基于吸附效率以及缩短实验时间考虑,最终选择20 min作为最佳条件。
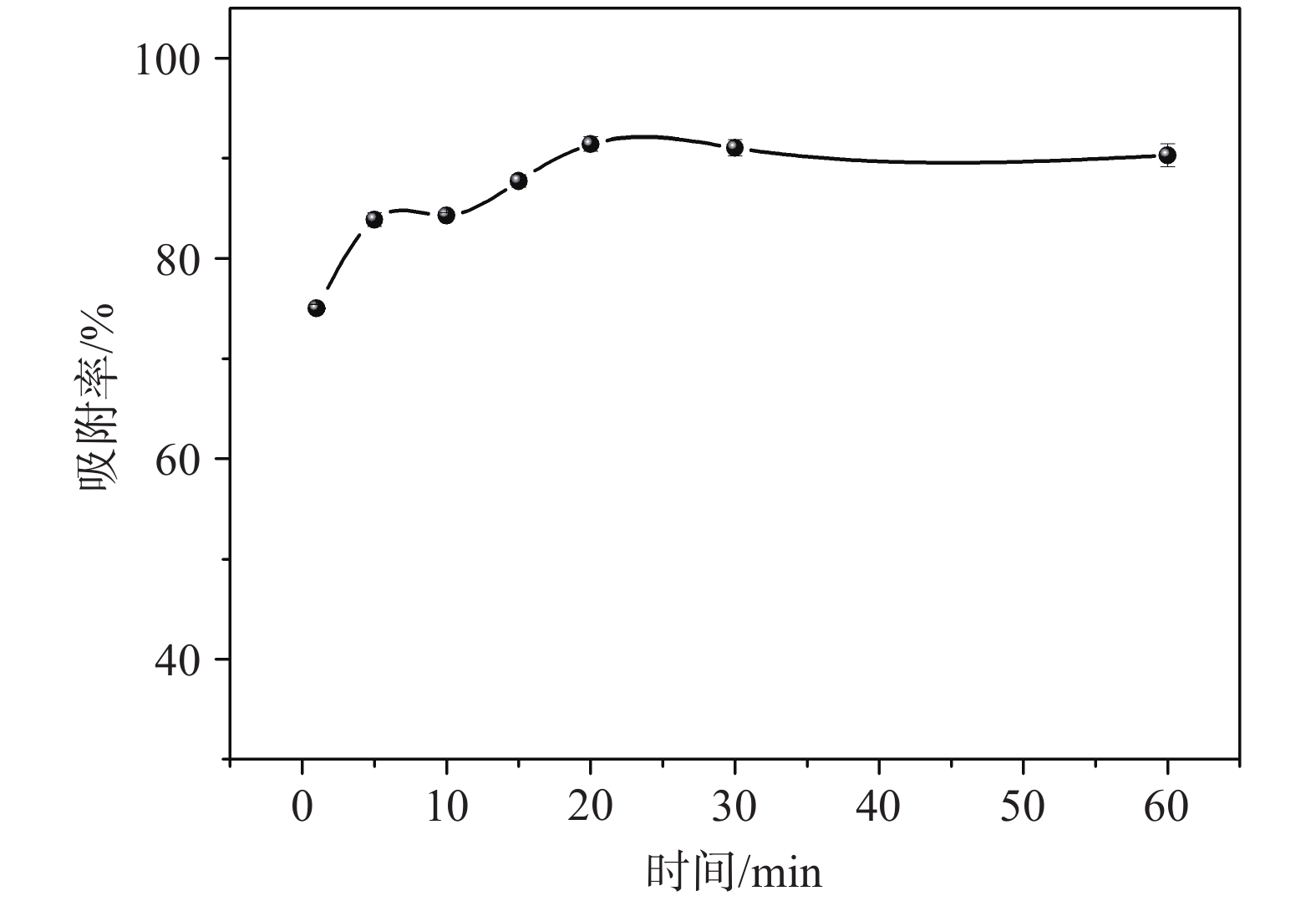
|
| 图 4 吸附效率随吸附时间变化曲线 |
2.2.3 吸附剂Fe3O4 MNPs加入量考察
Fe3O4 MNPs浓度对吸附效率的影响如图5所示。当Fe3O4 MNPs浓度由0.5 g/L增大至2 g/L过程中,随着Fe3O4 MNPs加入量增大,其对As(III)的吸附效率逐渐升高;但当Fe3O4 MNPs浓度大于2 g/L后,吸附效率达到平台。因此最终选择2 g/L作为最佳浓度。

|
| 图 5 四氧化三铁加入量的影响 |
2.3 干扰考察
本实验考察了12种常见干扰离子对As(III)测定结果的影响,结果列于表2。考察结果显示,该方法具有较强的抗干扰能力,常见干扰离子即使在浓度高于砷离子浓度100~1 000倍时也不会对分析结果造成明显干扰。
| 干扰 | 干扰浓度/(mg·L–1) | As浓度/(mg·L–1) | As回收率/% |
| Pb(II) | 1 | 1 000 | 119 |
| Na(I) | 1 | 1 000 | 101 |
| Ca(II) | 1 | 1 000 | 119 |
| Cu(II) | 1 | 1 000 | 113 |
| Zn(II) | 1 | 1 000 | 99 |
| Ni(II) | 1 | 1 000 | 93 |
| Fe(III) | 0.1 | 100 | 113 |
| K(I) | 1 | 1 000 | 100 |
| Ba(II) | 1 | 1 000 | 86 |
| Mg(II) | 0.1 | 100 | 114 |
| Sr(II) | 1 | 1 000 | 91 |
| Hg(II) | 1 | 1 000 | 96 |
2.4 方法分析性能考察
在最优的条件下,分别考察加入Fe3O4 MNPs富集前后方法的分析性能。实验结果如表3所示,经过Fe3O4 MNPs富集,方法检出限(LOD=3
| 详细参数 | 未富集 | 富集 |
| 线性方程 | y=16.256 5x+2.114 1 | y=863.3x+7.503 5 |
| 线性范围/(ng·mL–1) | 1~10 | 0.1~10 |
| 相关系数R2 | 0.996 6 | 0.997 1 |
| LOD/(ng·mL–1) | 0.19 | 0.004 |
| LOQ/(ng·mL–1) | 0.63 | 0.013 |
| RSD/% | 1.9 | 2.0 |
2.5 实际样品测定
为了验证本方法的准确性,我们分别对两种细胞样品以及3种环境水样、一种标准水体样品中的As(III)进行了检测,分析结果如表4所示。在对细胞样品的分析中,草履虫细胞及巨噬细胞均培养于1 μg/mL As(III)环境下,分析结果发现两种细胞内均有As(III)存在,加标回收率为97%~120%(经过t检验,置信度为95%)。采用本方法在3种市内河水样品中均可检测到痕量砷存在,其浓度均符合国家标准《生活饮用水卫生标准》(<10 μg/L),加标回收率在86%~108%之间。在对标准水样的检测中,标准物质测定值与参考值比值达96%。上述分析结果显示本方法具有较高的准确度。
| 样品 | 是否富集 | 加标量/(ng·mL–1) | 测定值/(ng·mL–1) | 标准物质参考值/(μg·g–1) | 回收率/% |
| 府南河 | 否 | - | ND | - | |
| 是 | - | 0.93±0.01 | - | ||
| 是 | 0.5 | 1.42±0.01 | 0.50±0.01 | 98 | |
| 是 | 5.0 | 5.97±0.03 | 101 | ||
| 是 | 10 | 10.95±0.02 | 100 | ||
| 沙河 | 否 | - | ND | - | |
| 是 | - | 1.09±0.03 | - | ||
| 是 | 0.5 | 1.63±0.01 | 0.50±0.01 | 108 | |
| 是 | 5.0 | 6.25±0.02 | 103 | ||
| 是 | 10 | 10.85±0.01 | 98 | ||
| 杨柳河 | 否 | - | ND | - | |
| 是 | - | 0.54±0.02 | - | ||
| 是 | 0.5 | 0.97±0.01 | 0.50±0.01 | 86 | |
| 是 | 5.0 | 5.50±0.03 | 99 | ||
| 是 | 10 | 10.15±0.03 | 96 | ||
| 草履虫 | 是 | - | 1.87±0.01 | 0.50±0.01 | - |
| 是 | 0.5 | 2.47±0.01 | 120 | ||
| 是 | 5.0 | 6.75±0.02 | 98 | ||
| 是 | 10.0 | 12.47±0.02 | 116 | ||
| 巨噬细胞 | 是 | - | 1.60±0.03 | 0.50±0.01 | - |
| 是 | 0.5 | 2.12±0.01 | 104 | ||
| 是 | 5.0 | 6.60±0.03 | 100 | ||
| 是 | 10.0 | 11.30±0.04 | 97 | ||
| GBW08605 | 是 | - | 0.48±0.01 | 0.50±0.01 | 96 |
| 注:1)Mean±SD (n=3);ND:未检测到。 | |||||
3 结束语
本实验采用简单方法在室温下制备Fe3O4 MNPs,并首次将其用于细胞样品中砷的分离富集,通过氢化物发生原子荧光光谱法对砷进行高灵敏分析。相比于传统的分离富集方法,该分析方法具有操作简单、富集效率高、灵敏度高、抗干扰能力强等特点,是一种针对环境及细胞样品中痕量砷的高灵敏分析方法。在未来的工作中,通过对Fe3O4 MNPs磁性纳米材料进行表面改性,该磁性分离-氢化物发生原子光谱分析技术极有可能推广到细胞中其他痕量元素的分析中,成为一种针对生物样品的元素分析有效手段。
| [1] |
SANCHEZ T R, PERZANOWSKI M, GRAZIANO J H. Inorganic arsenic and respiratory health, from early life exposure to sex-specific effects: A systematic review[J].
Environmental Research, 2016, 147: 537-555.
DOI:10.1016/j.envres.2016.02.009 |
| [2] |
MCGUIGAN C F, HAMULA C L A, HUANG S, et al. A review on arsenic concentrations in Canadian drinking water[J].
Environmental Reviews, 2010, 18: 291-307.
DOI:10.1139/A10-012 |
| [3] |
陈倩, 苏建强, 叶军, 等. 微生物砷还原机制的研究进展[J].
生态毒理学报, 2011, 3(6): 225-233.
|
| [4] |
HETTICK B E, CANAS-CARRELL J E, FRENCH A D, et al. Arsenic: A Review of the Element's Toxicity, Plant Interactions, and Potential Methods of Remediation[J].
Journal of Agricultural and Food Chemistry, 2015, 63(32): 7097-7107.
DOI:10.1021/acs.jafc.5b02487 |
| [5] |
ZHOU Z D, LUO H, HOU X D, et al. Determination of arsenic in dinosaur skeleton fossils by hydride generation atomic fluorescence spectrometry[J].
Microchemical Journal, 2004, 77(1): 29-35.
DOI:10.1016/j.microc.2003.11.002 |
| [6] |
LUO H, WANG X, DAI R, et al. Simultaneous determination of arsenic and cadmium by hydride generation atomic fluorescence spectrometry using magnetic zero-valent iron nanoparticles for separation and pre-concentration[J].
Microchemical Journal, 2017, 133: 518-523.
DOI:10.1016/j.microc.2017.04.030 |
| [7] |
JIANG H M, HU B, CHEN B B, et al. Hollow fiber liquid phase microextraction combined with electrothermal atomic absorption spectrometry for the speciation of arsenic (III) and arsenic (V) in fresh waters and human hair extracts[J].
Analytica Chimica Acta, 2009, 634(1): 15-21.
DOI:10.1016/j.aca.2008.12.008 |
| [8] |
ZHU Z L, HE H Y, HE D, et al. Evaluation of a new dielectric barrier discharge excitation source for the determination of arsenic with atomic emission spectrometry[J].
Talanta, 2014, 122: 234-239.
DOI:10.1016/j.talanta.2014.01.054 |
| [9] |
ZOU Z R, WANG S L, JIA J, et al. Ultrasensitive determination of inorganic arsenic by hydride generation-atomic fluorescence spectrometry using Fe3O4@ZIF-8 nanoparticles for preconcentration[J].
Microchemical Journal, 2016, 124: 578-583.
DOI:10.1016/j.microc.2015.10.005 |
| [10] |
TANG S, ZHANG H, LEE H K. Advances in Sample Extraction[J].
Analytical Chemistry, 2016, 88(1): 228-249.
DOI:10.1021/acs.analchem.5b04040 |
| [11] |
PYRZYNSKA K, KUBIAK A, WYSOCKA I. Application of solid phase extraction procedures for rare earth elements determination in environmental samples[J].
Talanta, 2016, 154: 15-22.
DOI:10.1016/j.talanta.2016.03.022 |
| [12] |
ANTHEMIDIS A N, IOANNOU K I G. Recent developments in homogeneous and dispersive liquid-liquid extraction for inorganic elements determination. A review[J].
Talanta, 2009, 80(2): 413-421.
DOI:10.1016/j.talanta.2009.09.005 |
| [13] |
HAMSIPUR M, FATTAHI N, ASSADI Y, et al. Speciation of As(III) and As(V) in water samples by graphite furnace atomic absorption spectrometry after solid phase extraction combined with dispersive liquid-liquid microextraction based on the solidification of floating organic drop[J].
Talanta, 2014, 130: 26-32.
DOI:10.1016/j.talanta.2014.06.049 |
| [14] |
孙梅, 刘桂建, 吴强华. 浊点萃取技术在环境样品痕量元素分析中的应用研究进展[J].
环境化学, 2013, 32(6): 1016-1024.
DOI:10.7524/j.issn.0254-6108.2013.06.015 |
| [15] |
SEN G S. Adsorption of metal ions by clays and inorganic solids[J].
Rsc Advances, 2014, 54(4): 28537-28586.
DOI:10.1039/C4RA03673E |
| [16] |
DABROWSKI A, HUBICKI Z, PODKOSCIELNY P. Selective removal of the heavy metal ions from waters and industrial wastewaters by ion-exchange method[J].
Chemosphere, 2004, 56(2): 91-106.
DOI:10.1016/j.chemosphere.2004.03.006 |
| [17] |
安明日, 陈明丽, 王建华. 纳米Fe3O4分离富集-悬浮进样-氢化物发生原子荧光法测定砷形态
[J].
分析化学, 2013, 41(1): 105-109.
|
| [18] |
谢建新, 吴云英, 陈文静, 等. Fe3O4/MnO2复合纳米材料对水中刚果红吸附性能研究
[J].
贵州师范大学学报(自然科学版), 2017, 35(6): 89-92.
DOI:10.3969/j.issn.1004-5570.2017.06.011 |
| [19] |
YU H, AI X, XU K, et al. UV-assisted Fenton digestion of rice for the determination of trace cadmium by hydride generation atomic fluorescence spectrometry[J].
Analyst, 2016, 141(4): 1512-1518.
DOI:10.1039/C5AN02068A |
 2018, Vol. 44
2018, Vol. 44


 ,
,