文章信息
- 李超, 王素娟, 秦云华, 刘秀明, 范多青, 李娥贤, 李响丽, 郭丽娟
- LI Chao, WANG Sujuan, QIN Yunhua, LIU Xiuming, FAN Duoqing, LI E’xian, LI Xiangli, GUO Lijuan
- GC-MS法同时快速测定酒精中9种醇类化合物的含量
- Simultaneous rapid determination of 9 alcohol compounds in alcohol by GC-MS
- 中国测试, 2019, 45(1): 77-82,114
- CHINA MEASUREMENT & TEST, 2019, 45(1): 77-82,114
- http://dx.doi.org/10.11857/j.issn.1674-5124.2018070018
-
文章历史
- 收稿日期: 2018-07-12
- 收到修改稿日期: 2018-08-09
2. 云南省农业科学研究院生物技术与种质资源研究所,云南 昆明 650223
2. Institute of Biotechnology and Genetic Resources, Yunnan Academy of Agricultural Sciences, Kunming 650223, China
白酒在发酵过程中除了产生乙醇和水外,还会产生少量的甲醇和杂醇油,杂醇油为白酒中不可缺少的香气成分之一,但含量过高,与酸、酯等成分比例失调,则为白酒异杂味的主要原因,目前对白酒中杂醇油的含量分析较多[1-7]。杂醇油是发酵法生产酒精的副产物,它在酒精发酵过程中形成,而在酒精蒸馏中被分离出来,提取率一般为0.4%~0.6%。酒精提取制备过程中不可避免地会产生醇类化合物,如甲醇、1-丙醇、仲丁醇、异丁醇、1-丁醇,庚醛、辛醇、壬醇等20多种物质[8-10]。杂醇油精制除水后,经分馏可分离出乙醇-丙醇混合物,异丁醇和异戊醇。
目前测定酒中的杂醇油常用的方法主要是比色法[11]和气相色谱法[12-18]。比色法操作比较繁琐,灵敏度低,干扰因素多,测定误差大,且只能测定单一组分。气相色谱法(FID检测器)也可用于检测醇类化合物的含量,但是由于仪器检测灵敏度较低,对于痕量醇类的检验常常不能满足要求。另外,气相色谱法(FID检测器)在测定同分异构体化合物时,容易受到干扰,例如仲戊醇和异戊醇。因此,对于酒精中杂醇类化合物的测定急需开发出一种高灵敏度、低检出限、抗干扰的仪器分析方法。毛细管柱气相色谱法-质谱法,由于其分析速度更快,进样量也更少,总柱效更好,是当前比较全面的方法[1]。因此本实验采用DB-624毛细管柱直接进样,氘代-1-丙醇为内标,建立了一种GC-MS法同时快速测定酒精中9种醇类化合物的含量,并对该方法的性能指标进行考察,取得了良好的结果。
1 试验部分 1.1 仪器与试剂Perkin Elmer Clarus 600T型气相色谱质谱联用仪(美国Perkin Elmer公司);DB-624毛细管柱(60 m×0.32 mm,1.8 μm,美国Agilient公司);AE200型电子分析天平(德国Mettler公司);振荡器(HY-5A回旋调速多用振荡器,上海兰仪实业有限公司)。
无水硫酸钠(分析纯,用前550 ℃烘2~3 h,冷却后,放置于干燥器中备用),乙醇(色谱纯,纯度为99.9%);甲醇(纯度为99.9%);1-丙醇(纯度为99.9%);仲丁醇(纯度为99.5%);异丁醇(纯度为99.8%);正丁醇(纯度为99.8%);仲戊醇(纯度为99.5%);异戊醇(纯度为99.6%);正戊醇(纯度为99.5%);正己醇(纯度为99.8%);氘代-1-丙醇-1,1,3,3,3-d5(CAS号:188894-71-5,纯度为99.3%)。
1.2 标准溶液配制 1.2.1 内标储备液称取10 mg氘代-1-丙醇-1,1,3,3,3-d5于50 mL棕色容量瓶中,精确至0.1 mg,用乙醇定容至刻度,配制成浓度为200 mg/L的内标溶液。内标储备液在0 ~4 ℃条件下密封存放,有效期3个月。
1.2.2 混合标准储备液准确称取50 mg甲醇、1-丙醇、仲丁醇、异丁醇、正丁醇、仲戊醇、异戊醇、正戊醇和正己醇于同一25 mL棕色容量瓶中,精确至0.1 mg,用乙醇定容至刻度,配制成浓度为2 000 mg/L的混合标准储备液。混合标准储备液在0~4 ℃条件下密封存放,有效期3个月。
1.2.3 一级混合标准溶液准确移取2 mL混合标准储备液至50 mL棕色容量瓶中,用乙醇定容至刻度,配制成浓度为80 mg/L的一级混合标准溶液,现配现用。
1.2.4 系列标准工作溶液根据样品实际含量配制合适浓度的系列标准工作溶液。推荐如下配制方法:分别准确移取0.1 ,0.5 ,1 ,2,5 mL一级混合标准溶液于10 mL棕色容量瓶中,加入100 μL内标储备液,用乙醇定容至刻度,即得系列标准工作溶液,现配现用。
1.3 气相色谱质谱条件色谱条件:色谱柱:DB-624毛细管柱;载气:氦气(He);流量:1.5 mL/min;程序升温:初始温度50 ℃,保持5 min,以10 ℃/min升至160 ℃,再以60 ℃/min升至220 ℃,保持10 min;进样口温度:230 ℃;分流进样,分流比20∶1,进样量1 μL。
质谱条件:离子源:EI;离子化能量:70 eV;离子源温度:230 ℃;传输线温度:230 ℃;溶剂延迟:0~4.3 min,5.3~8.1 min;质谱扫描范围:29~300 m/z;扫描模式:SIM模式。
采用NIST图谱库检索,对照标准品与样品色谱峰的保留时间及离子丰度比进行定性,内标法定量。
1.4 试验方法 1.4.1 样品前处理称取0.5 g烟用酒精样品于50 mL具塞离心管中,精确至0.1 mg,分别准确加入15.0 mL乙醇和150 μL内标储备液,摇匀,静置2 min,取上层清液经0.22 μm有机相滤膜过滤,滤液进行GC-MS分析。
1.4.2 色谱条件优化对检测分析时的色谱条件进行优化,主要从色谱柱的选择、初始温度、检测器温度及载气流量等方面来分别进行研究和优化。
2 结果与讨论对检测分析时的分析条件进行优化,主要从色谱条件、内标物选择、样品前处理条件等方面来分别进行研究和优化。
2.1 分析条件的优化 2.1.1 色谱条件的选择目标化合物为极性挥发性的物质,宜选用极性柱进行分析,该实验方法选择适合醇类分析的固定相为聚乙二醇的DB-624毛细管柱,规格为:(60 m×0.32 mm,1.8 μm),结果表明,9种醇类化合物完全实现了基线分离。
目标物为一类化合物,目标物的沸点范围在64.7~157 ℃之间,结合目标物的沸点,选择了初始温度为40,50,60,70,80 ℃分别进行实验。实验表明,40 ℃时,醇类出峰的峰展宽现象严重,随着初始温度的升高,醇类的峰形逐渐变得尖锐,峰宽越来越窄,保留时间逐渐变短,乙醇和丙醇的分离度变差,70 ℃后,乙醇和丙醇不能实现基线分离,且甲醇的保留时间变短,出峰太快,当初始温度50 ℃时,醇类峰形较好,均实现基线分离,同时采用程序升温,调整分流比,进样口、检测器温度及载气流速等获得最佳分离条件,9种化合物的标准品及样品的选择离子扫描图详见图1和图2。
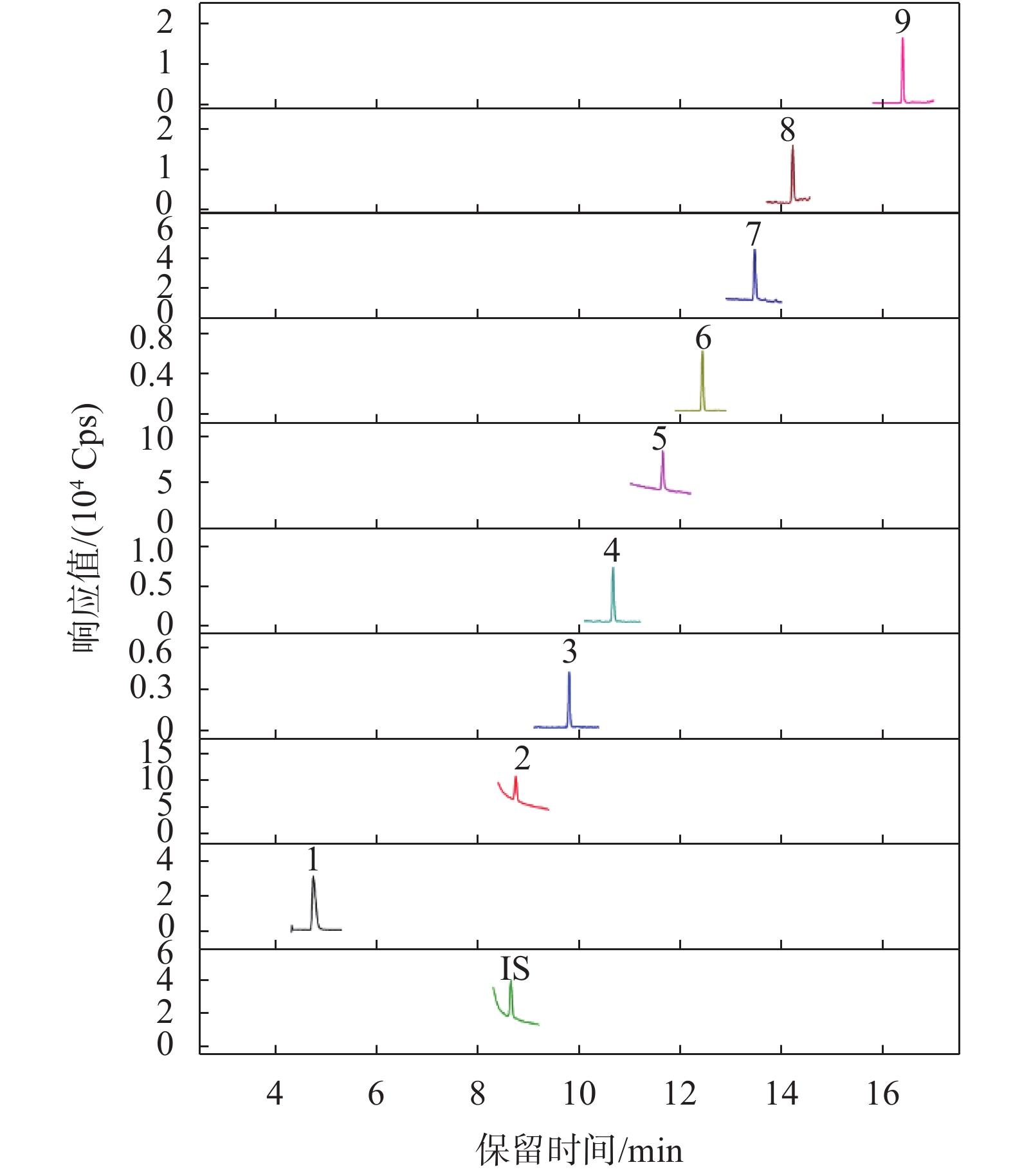
|
| 图 1 9种目标物标准溶液及内标物标准溶液的选择离子色谱图 Fig. 1 Selected ion chromatograms of 9 target and internal standard solutions |

|
| 图 2 9种目标物样品及内标物标品中的总离子流图及选择离子色谱图 Fig. 2 Selected ion chromatograms of 9 target samples and internal standard of solutions |
2.1.2 内标的选择
采用与目标物的化学性质相近的物质作内标,可以减少样品损失带来的分析误差,提高检测结果的准确性。综合考虑目标物的物理性质、化学性质,本方法选择氘代-1-丙醇-1,1,3,3,3-d5作为内标,内标选择原因如下:同位素内标不存在于待测样品中;完全溶于试样并与各组分的色谱峰完全分离;出峰位置在9个目标物中间;内标与目标物属一类物质,仪器、外界环境条件等相应的影响一致。因此选择氘代-1-丙醇-1,1,3,3,3-d5作为内标。
2.1.3 样品前处理条件优化1)称样量考察。选取经典的称样量进行考察,称样量分别为0.2,0.5,1 g,每个称样量进行5个平行样测定,结果表明,称样量为0.2 g时,9种化合物的RSD在2.78%~6.21%之间,称样量为0.5 g时,9种化合物的RSD在1.36%~4.31%之间,称样量为1 g时,9种化合物的RSD在3.12%~4.72%之间。综合考虑称样量选择0.5 g。
2)萃取溶剂的选择。文献报道的9种醇类目标物的萃取溶剂主要有乙醇和水,气相色谱柱受水的影响,峰形变差,水的存在会影响色谱柱的性能和使用寿命,因此该实验方法加入5 g无水Na2SO4除去食品添加剂中的水分,考虑到目标物均为醇类物质,根据“相似相容原理”,选择乙醇作为萃取溶剂,稀释和提取目标物。
3)溶剂体积的优化。加标制备一个中等浓度的实验样品,选择5,10,15,20,25 mL萃取体积进行优化,结果如图3所示。实验表明,萃取体积为15 mL时,萃取效率最佳。
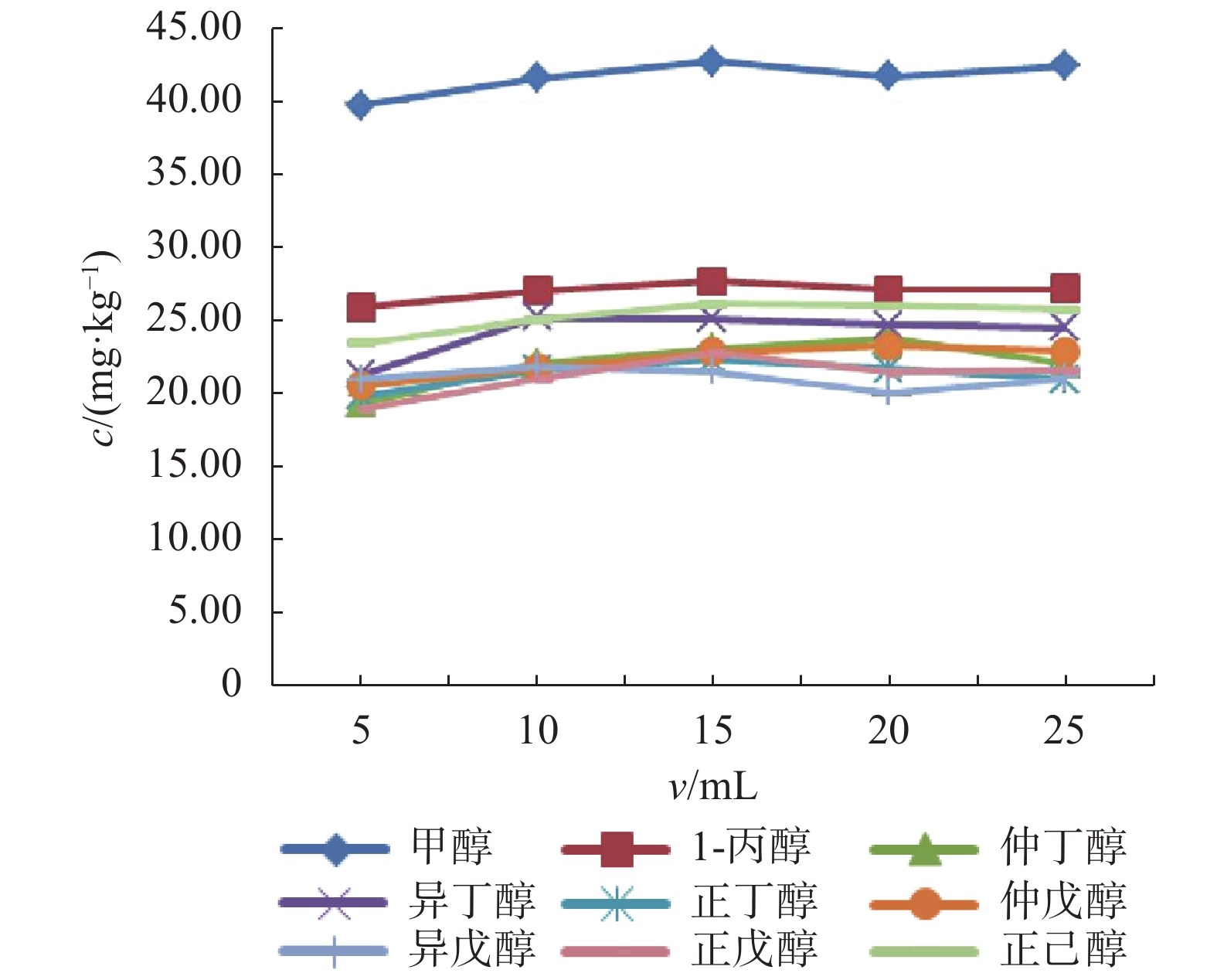
|
| 图 3 不同萃取体积的优化结果 Fig. 3 Optimization results of different extraction volumes |
4)萃取方式的优化。加标制备一个中等浓度的实验样品,对超声、振荡、涡旋3种方式进行优化考察,结果如图4所示。结果表明,超声仅让样品分子在小范围内振动,混匀效果差,且超声过程中的发热易造成挥发性目标物的损失,特别是对于检出率高的甲醇,涡旋振荡的萃取方式也易造成目标物的损失。综合考虑选择振荡的萃取方式。

|
| 图 4 萃取方式的选择图 Fig. 4 Selection of extraction method |
5)萃取时间的优化。加标制备一个中等浓度的实验样品,选择2,5,10,15,20 min进行时间优化选择,结果如图5所示。综合考虑选择5 min为最佳萃取时间。

|
| 图 5 萃取时间的优化图 Fig. 5 Optimization diagram of extraction time |
2.2 方法学考察 2.2.1 线性关系、检出限和定量限
利用优化的色谱条件和质谱条件,分别对所配制的系列标准溶液进行测定,9种目标物及内标物标准溶液的总离子流图及选择离子色谱图如图1所示,采用选择离子扫描方式对9种化合物及内标物进行检测,表1汇总了9种化合物及内标物的定量和定性选择离子等信息。
| 化合物 | 保留时间/
min |
定性离子/
(m·z–1) |
定量离子/
(m·z–1) |
| 甲醇 | 4.74 | 31,29 | 31 |
| 1-丙醇 | 8.75 | 59,42,31 | 59 |
| 仲丁醇 | 9.81 | 59,45,31 | 45 |
| 异丁醇 | 10.67 | 43,33,74 | 33 |
| 正丁醇 | 11.65 | 56,43,31 | 56 |
| 仲戊醇 | 12.45 | 55,45,73 | 45 |
| 异戊醇 | 13.47 | 70,42,55 | 70 |
| 正戊醇 | 14.22 | 42,55,70 | 42 |
| 正己醇 | 16.40 | 56,43,55 | 56 |
| 氘代-1-丙醇-1,1,3,3,3-d5 | 8.65 | 33,46,65 | 33 |
以待测组分和内标的色谱峰面积比y对待测组分和内标的浓度比x进行线性回归。从表2可以看出,9种待测组分在0.2~10 mg/L的范围内线性关系良好,相关系数大于0.993,9种目标物的检出限在0.18~0.26 mg/kg之间,定量限在0.60~0.85 mg/kg之间。
| 化合物 | 线性范围/(mg·L–1) | 线性方程 | 相关系数 | 检出限/(mg·kg–1) | 定量限/(mg·kg–1) |
| 甲醇 | 0.2~10 | y=451.691x+849.214 | 0.999 | 0.26 | 0.85 |
| 正丙醇 | 0.2~10 | y=62.3609x+44.285 6 | 0.993 | 0.22 | 0.75 |
| 仲丁醇 | 0.2~10 | y=169.217x–18.395 9 | 0.999 | 0.19 | 0.62 |
| 异丁醇 | 0.2~10 | y=260.698x+7.021 63 | 0.999 | 0.20 | 0.67 |
| 正丁醇 | 0.2~10 | y=400.709x+3.470 01 | 0.999 | 0.22 | 0.73 |
| 仲戊醇 | 0.2~10 | y=360.352x+3.320 91 | 0.999 | 0.24 | 0.79 |
| 异戊醇 | 0.2~10 | y=442.057x+28.883 7 | 0.999 | 0.22 | 0.73 |
| 正戊醇 | 0.2~10 | y=413.802x–41.722 4 | 0.999 | 0.22 | 0.73 |
| 正己醇 | 0.2~10 | y=169.217x–18.395 9 | 0.999 | 0.18 | 0.60 |
| 注:1)y-峰面积比;x-浓度比。 | |||||
2.2.2 回收率和精密度
对食品添加剂样品添加有低、中、高3个浓度水平:4,8,10 mg/L,按照优化方法对样品进行前处理,平行测定6次,测定平均回收率和相对标准偏差(RSD),测定结果详见表3。从实验结果可以看出,加标实验的平均回收率在89.4%~105.2%之间,相对标准偏差在1.89%~4.28%之间,方法具有良好的重现性和回收率。
| 化合物名称 | 加标量/(mg·L–1) | |||||||
| 4 | 8 | 10 | ||||||
| 回收率 | RSD | 回收率 | RSD | 回收率 | RSD | |||
| 甲醇 | 94.2 | 2.32 | 101.3 | 3.31 | 105.0 | 3.41 | ||
| 正丙醇 | 89.4 | 3.65 | 93.6 | 3.51 | 99.3 | 2.26 | ||
| 仲丁醇 | 97.2 | 3.23 | 95.9 | 4.28 | 100.3 | 1.89 | ||
| 异丁醇 | 95.3 | 4.17 | 92.6 | 3.87 | 101.3 | 3.19 | ||
| 正丁醇 | 98.5 | 4.06 | 104.3 | 2.92 | 96.8 | 2.68 | ||
| 仲戊醇 | 102.4 | 3.27 | 102.6 | 3.92 | 93.2 | 2.34 | ||
| 异戊醇 | 94.3 | 2.81 | 99.2 | 3.56 | 98.6 | 2.55 | ||
| 正戊醇 | 101.3 | 2.79 | 97.3 | 3.03 | 105.2 | 3.31 | ||
| 正己醇 | 95.6 | 3.41 | 89.5 | 2.78 | 100.4 | 2.97 | ||
利用优化的色谱条件、质谱条件和前处理方法,对25个酒精样品进行检测,检测结果详见表4。结果表明,仲丁醇、仲戊醇均未检出;而正己醇、甲醇、正丙醇、异丁醇、1-丁醇、异戊醇、1-戊醇7种醇均有检出,检出含量范围为2.01~105.30 mg/kg,检出率超过90%。
| 样品编号 | 甲醇 | 正丙醇 | 仲丁醇 | 异丁醇 | 1-丁醇 | 仲戊醇 | 异戊醇 | 1-戊醇 | 正己醇 |
| yp-1 | 20.42 | 19.11 | − | − | 82.89 | − | − | − | − |
| yp-2 | 2.64 | 9.20 | − | − | − | − | − | − | − |
| yp-3 | 4.76 | 8.42 | − | − | − | − | − | − | − |
| yp-4 | 41.99 | 96.71 | − | − | − | − | − | − | − |
| yp-5 | 56.35 | 79.06 | − | − | − | − | − | − | − |
| yp-6 | 54.53 | − | − | − | − | − | − | − | − |
| yp-7 | − | 36.23 | − | − | 2.01 | − | − | − | 56.26 |
| yp-8 | 10.31 | 10.09 | − | − | − | − | − | − | − |
| yp-9 | 44.83 | 56.07 | − | − | − | − | − | − | − |
| yp-10 | 43.48 | 47.83 | − | − | − | − | − | − | − |
| yp-11 | 37.66 | 44.21 | − | − | − | − | − | − | − |
| yp-12 | 32.28 | 23.73 | − | − | − | − | − | − | − |
| yp-13 | 39.14 | 15.25 | − | − | − | − | − | − | − |
| yp-14 | 40.27 | 102.47 | − | − | − | − | − | − | − |
| yp-15 | 30.24 | 27.67 | − | − | − | − | 32.14 | − | − |
| yp-16 | 2.76 | 16.23 | − | − | − | − | − | 4.27 | − |
| yp-17 | 3.23 | − | − | − | − | − | − | − | − |
| yp-18 | 3.45 | − | − | − | − | − | − | − | − |
| yp-19 | 8.67 | 1.57 | − | − | − | − | − | − | − |
| yp-20 | 25.31 | 105.30 | − | 34.87 | − | − | − | − | − |
| yp-21 | 3.67 | 19.23 | − | − | − | − | − | − | − |
| yp-22 | 8.24 | 6.57 | − | − | − | − | − | − | − |
| yp-23 | 26.80 | 101.21 | − | 36.41 | − | − | − | − | − |
| yp-24 | − | − | − | − | − | − | − | − | − |
| yp-25 | 7.94 | 11.68 | 3.48 | − | − | − | − | − | |
| 注:1)− 代表未检出。 | |||||||||
此外,进样过程中,每进10个样品,插入一个溶剂空白样品进行测定,没有发现样品残留在色谱柱上,且在进样50次以后,保留时间的位置没有发生漂移,说明该方法稳定、可靠。
3 结束语本方法建立了GC-MS法测定酒精中9种杂醇类化合物的检测方法,研究了方法的色谱条件、内标物选择、样品前处理等因素对检测结果的影响,并对条件予以优化。在优化的条件下,该方法具有分离能力强、检测通量高、灵敏度高、检测限低、分析速度快等优点。另外,该方法能在测定仲丁醇、异丁醇、1-丁醇;异戊醇、仲戊醇、1-戊醇时消除同分异构体化合物的干扰,提升测定的准确度。9种醇类化合物在0.2~10 mg/L内有很好的线性范围,相关系数均在0.993以上,定量限在0.60~0.85 mg/kg之间,加标实验的平均回收率在89.4%~105.2%之间,相对标准偏差(RSD)在1.89%~4.28%之间,实验结果表明该方法简便、快速、准确,方法适用于酒精中9种杂醇类化合物的同时分析测定,可用于酒精样品日常的批量快速检测。
| [1] |
王珍, 周洋, 李春丽, 等. 浅谈白酒中杂醇油的分析方法[J].
酿酒科技, 2017, 276(6): 77-79.
DOI:10.13746/j.njkj.2017057 |
| [2] |
孙伟, 汪清美. 气相色谱法测定白酒中的甲醇和杂醇油[J].
信阳农业高等专科学校学报, 2014, 24(2): 109-111.
DOI:10.3969/j.issn.1008-4916.2014.02.033 |
| [3] |
李珍, 杨洋. 改良气相色谱分析法分离测定11种杂醇油[J].
食品安全导刊, 2017(33): 74-75.
DOI:10.3969/j.issn.1674-0270.2017.36.057 |
| [4] |
彭清涛, 王力. 毛细管气相色谱法同时测定白酒中的甲醇和杂醇油[J].
化学分析计量, 2007(1): 33-34.
DOI:10.3969/j.issn.1008-6145.2007.01.010 |
| [5] |
湛社霞, 卢佑演, 张宏, 等. 蒸馏酒中甲醇和杂醇油测定的色谱条件优化[J].
中国卫生检验杂志, 2011, 21(8): 1944-1946.
|
| [6] |
洪薇, 符传武. 气相色谱法同时测定白酒中的8种物质[J].
中国酿造, 2015(10): 134-137.
DOI:10.11882/j.issn.0254-5071.2015.10.030 |
| [7] |
罗杰, 敖宗华, 王松涛, 等. 浓香型白酒不同类别基酒中杂醇油相关性研究[J].
酿酒科技, 2015(1): 43-44.
|
| [8] |
童永鑫, 李玲, 杨文宇, 等. 气相色谱法测定石榴葡萄酒中的甲醇和杂醇油[J].
中国酿造, 2013, 32(3): 142-145.
DOI:10.3969/j.issn.0254-5071.2013.03.036 |
| [9] |
熊道陵, 李金辉, 钟洪鸣. 杂醇油提纯分离技术及应用[J].
酿酒科技, 2008(4): 65-68.
|
| [10] |
王立钊, 梁慧珍, 马树奎,等. 影响固态发酵白酒中杂醇油生成因素的研究[J].
酿酒科技, 2006(5): 43-45,48.
DOI:10.3969/j.issn.1001-9286.2006.05.007 |
| [11] |
陈丽娟, 郭春芳. 比色法测白酒中杂醇油含量方法探讨[J].
酿酒, 2009, 28(5): 71-72.
DOI:10.3969/j.issn.1004-7360.2009.05.022 |
| [12] |
吴林芬, 杨光宇, 胡秋芬, 等. 气相色谱法测定食用酒精中甲醇和杂醇油的含量[J].
云南民族大学学报(自然科学版), 2012, 21(4): 252-255.
DOI:10.3969/i.i8sn.1672-8513.2012.04.005 |
| [13] |
邓青, 邓岚, 荆碧. 毛细管气相色谱快速测定白酒中甲醇[J].
云南师范大学学报(自然科学版), 2002, 22(5): 42-43.
DOI:10.3969/j.issn.1007-9793.2002.05.010 |
| [14] |
王斌, 冯锡凯, 马立明. 气相色谱内标(环己烷)法测定蒸馏酒中甲醇、杂醇油含量[J].
中国卫生检验杂志, 2006, 16(7): 802-803.
DOI:10.3969/j.issn.1004-8685.2006.07.016 |
| [15] |
石相莉, 邓全道. 酒中甲醇、杂醇油、乙酸乙酯、己酸乙酯的检测[J].
中国卫生检验杂志, 2007, 17(11): 2107-2113.
DOI:10.3969/j.issn.1004-8685.2007.11.088 |
| [16] |
邹志辉, 张艳林, 苑丽红. 气相色谱法测定自酒中甲醇及杂油醇含量的探讨[J].
贵州农业科学, 2008, 36(2): 158-159.
DOI:10.3969/j.issn.1001-3601.2008.02.056 |
| [17] |
延鑫. 气相色谱法测定地方白酒中乙酸乙酯、杂醇油含量[J].
北京联合大学学报(自然科学版), 2009, 23(3): 53-56.
DOI:10.3969/j.issn.1005-0310.2009.03.013 |
| [18] |
李超, 段海波, 范多青, 等. 固相萃取-气质联用法同时快速测定水性胶黏剂中16种邻苯二甲酸酯[J].
分析试验室, 2014, 33(5): 592-596.
|
 2019, Vol. 45
2019, Vol. 45




