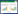文章信息
- 徐玉玲, 贺桢翔, 刘钱, 曾奇璐, 曹鑫, 吕海洋, 刘涛
- XU Yuling, HE Zhenxiang, LIU Qian, ZENG Qilu, CAO Xin, LÜ Haiyang, LIU Tao
- 基于纤维蛋白原活性的红花注射液抗凝血谱-效关系研究
- Study on the spectrum - effect relationship of anticoagulant activity of safflower injection based on fibrinogen activity
- 中国测试, 2019, 45(2): 59-63, 77
- CHINA MEASUREMENT & TEST, 2019, 45(2): 59-63, 77
- http://dx.doi.org/10.11857/j.issn.1674-5124.2018070064
2. 成都大学四川抗菌素工业研究所,四川 成都 610052
2. Sichuan Industrial Institute of Antibiotics, Chengdu University, Chengdu 610052, China
红花注射液由红花(Carthamus tinctorius L.)经水煮醇沉工艺加工而成,具有活血化瘀之功效,临床用于闭塞性脑血管等疾病的治疗[1]。红花注射液现行标准及相关质量研究文献主要集中于对其个别化学成分,如羟基红花黄色素A的定量测定与特征图谱研究等方面[2]。由于中药注射液成分复杂,临床使用时安全风险较大,控制个别成分含量无法控制药品的安全性、有效性和稳定性[3]。在一定波长下建立的指纹图谱可在一定程度上反应药品质量均一性及稳定性[4]。但是,中药指纹图谱仅控制了检视波长下可测定的成分,却并不能标示哪些成分与药物的药效相关,也并不能体现其相关程度;因此,只利用指纹图谱来评价中药质量还有较大局限性[5]。只有根据药物的基本属性,以药效为基准,并定量或定性控制与临床疗效相关的化学成分建立的药物质量标准,才能更好地评价中药质量,而中药谱-效相关性研究可以达到这一目的。谱-效关系研究由3个阶段组成,一是建立指纹图谱,二是建立药效学方法,三是采用合适的数据处理方法将指纹峰与药效数据进行关联分析,从而建立谱-效模型。
本研究通过建立红花注射液的HPLC指纹图谱,并采用纤维蛋白原平板法,以抗凝血效应强度为指标,对红花注射液抗凝血作用强度进行测定[6],运用“主成分分析-相关性分析-多重线性回归”的分析方法,对红花注射液抗凝血活性值和色谱指纹图谱数据建立谱-效回归评价模型,可以实现对药效作用的预测和评价。同时也可阐明指纹图谱特征与药效的相互关系,确定相应的药效物质基础,更有针对性地控制中药质量。
1 材 料iChrom P5100型高效液相色谱仪(大连依利特分析仪器有限公司);HS-3120超声波清洗器;JJ-CJ-2FD洁净工作台(苏州市金净净化设备科技有限公司);DH系列电热恒温培养箱(西安禾普生物科技有限公司);XFS-280手提式压力蒸汽灭菌器(浙江新丰医疗器械有限公司)。
凝血酶试剂(上海经科化学科技有限公司,批号T20180401);牛血纤维蛋白原试剂(上海经科化学科技有限公司,批号F20180401);氯化钠注射液(四川科伦药业股份有限公司,批号N17122008-1);紫丁香苷对照品(四川省维克奇生物科技有限公司,批号180218)。
13批红花注射液:公司A,批号170502、170701、170702、171001、171002、180101、180102、180401、180402、180403、180404;公司B,批号170314;公司C,批号170301。
2 方法与结果 2.1 红花注射液抗凝血活性值的测定 2.1.1 供试品溶液的制备将红花注射液与32 U/mL凝血酶按1∶1混合,混合反应30 min后即供试品溶液。
2.1.2 纤维蛋白原平板的制备取经高压蒸汽灭菌后的直径为10 cm的平皿,分别依次加入加热至85℃的1%琼脂溶液20 mL,0.3%的纤维蛋白原溶液15 mL,轻轻摇匀,冷却静置30 min,分别打出直径为3.5 mm的孔,备用[7]。
2.1.3 对照品溶液及阴性样品的制备精密称取活性为10 000 U的凝血酶粉末适量,用生理盐水配制浓度为40 U/mL的溶液,备用。阴性样品为纯净水。
2.1.4 标准曲线的绘制根据预实验结果,取纤维蛋白平板,分别精密吸取25 μL质量浓度2,4,6,8,10 U/mL的凝血酶溶液点样,置于恒温培养箱中(37℃)培养16 h,测定沉淀圈,以凝血酶浓度(U/mL)为横坐标(X),沉淀圈面积(mm2)为纵坐标(Y),得线性方程为Y=7.338 6X+31.939,r2=0.999 1。结果表明,凝血酶在2~10 U/mL与沉淀圈面积呈良好的线性关系。取纤维蛋白平板,分别精密吸取25 μL质量浓度8,16,24,32,40 U/mL的凝血酶点样,置于恒温培养箱中(37 ℃)培养16 h,测定沉淀圈,以凝血酶浓度(U/mL)为横坐标(X),沉淀圈面积(mm2)为纵坐标(Y),得线性方程为Y=5.668 5X+65.82,r2=0.994。结果表明,凝血酶在8~40 U/mL与沉淀圈面积呈良好的线性关系。
2.1.5 精密度试验1)同板精密度试验:取红花注射液(批号:170701)1 mL,按2.1.1方法制备供试品溶液,精密吸取25 μL,取纤维蛋白原平板,同板点样,共点6次,同时点样2,8,40 U/mL 的凝血酶、生理盐水、纯净水各25 μL,置于恒温培养箱中(37 ℃)培养16 h,测定抗凝血活性值,计算其RSD值为4.44%,结果表明同板精密度良好。
2)异板精密度试验:取红花注射液(批号:170701)1 mL,按2.1.1项方法制备供试品溶液,精密吸取25 μL,取纤维蛋白原平板,异板点样,共点6次,同时点样2,8,40 U/mL 的凝血酶、生理盐水、纯净水各25 μL,置于恒温培养箱中(37 ℃)培养16 h,测定抗凝血活性值,计算其RSD值为2.88%,结果表明异板精密度良好。
2.1.6 重复性试验取红花注射液(批号:170701)各1 mL,按2.1.1项方法分别平行制备6份供试品溶液,精密吸取25 μL,取纤维蛋白原平板,同板点样,同时点样2,8,40 U/mL的凝血酶、生理盐水、纯净水各25 μL,于恒温培养箱中(37 ℃)培养16 h,测定抗凝血活性值,计算RSD值为2.09%,结果表明重复性良好。
2.1.7 稳定性试验取红花注射液(批号:170701)各1 mL,按2.1.1项方法制备6份供试品溶液,精密吸取25 μL,取6个纤维蛋白原平板,凝血酶与供试品混合30 min后于0,1.0,1.5,2.0,2.5,3.0 h后分别点样,并同时点样2,8,40 U/mL的凝血酶、生理盐水、纯净水各25 μL,于恒温培养箱中(37 ℃)培养16 h,测定抗凝血活性值,计算其RSD值为4.48%,结果表明样品在3 h内稳定性良好。
2.1.8 加样回收率试验精密吸取红花注射液(批号170502,抗凝血活性值为10.71 U/mL)6份,每份与32 U/mL凝血酶按1∶1混合30 min后,再与20 U/mL凝血酶按1∶1混合30 min,取纤维蛋白原平板,同板点样,同时点样2,8,40 U/mL的凝血酶、生理盐水、纯净水各25 μL,于恒温培养箱中(37 ℃)培养16 h,测定抗凝血活性值,计算加样回收率为105.26%,RSD值为1.20%。
2.1.9 样品活性测定按2.1.1项方法制备7份供试品溶液(批号170502、170701、170702、171001、171002、180101、108102),取纤维蛋白原平板,同板点样,同时点样2,8,40 U/mL的凝血酶、生理盐水、纯净水各25 μL,置于恒温培养箱中(37 ℃)培养16 h,测定抗凝血活性值。测定结果如图1、表1所示。
| 批号 | 抗凝血活性值/(U·mL–1) | 批号 | 抗凝血活性值/(U·mL–1) | |
| 170502 | 10.71 | 171002 | 9.18 | |
| 170701 | 11.42 | 180101 | 10.22 | |
| 170702 | 10.48 | 180102 | 9.21 | |
| 171001 | 11.44 |

|
| 图 1 检品及凝血酶的免疫扩散反应 Fig. 1 immune diffusion reaction of the sample and thrombin 1. 2 U/mL凝血酶;2. 8 U/mL凝血酶;3. 40 U/mL凝血酶;4.~9. 供试品;10. 纯净水;11. 生理盐水。 |
2.2 红花注射液化学成分群数据库的建立 2.2.1 红花注射液供试品溶液的制备
精密移取红花注射液5.0 mL置于10 mL容量瓶中,加纯化水稀释至刻度,摇匀,既得供试品溶液。
2.2.2 色谱条件色谱柱为Supersil ODS2色谱柱(4.6 mm×250 mm,5 μm),流动相为甲醇(A)-10 mL/L冰醋酸溶液(B),梯度洗脱(0~90 min,0%~70%A);体积流量1.0 mL/min,进样体积10 μL;检验波长270 nm;柱温30 ℃。
2.2.3 稳定性试验取红花注射液(批号170701)按2.2.1项方法制备供试品溶液,将同一供试品溶液分别于0,3,6,9,12,15,18,21,24 h进样分析,计算各共有峰相对峰面积和相对保留时间,其RSD值分别小于2.00%和1.00%,以0 h的图谱数据作为参照,相似度RSD值小于1%,结果表明供试品在24 h内稳定。
2.2.4 精密度试验取红花注射液(批号170701)按2.2.1项方法制备供试品溶液,同一供试品溶液重复进样5次,计算各共有峰相对峰面积和相对保留时间,其RSD值分别小于2.00%和1.00%,以第1次进样的图谱数据作为参照,相似度RSD值小于1%,结果表明仪器精密度良好。
2.2.5 重复性试验取红花注射液(批号170701)按2.2.1项方法平行制备供试品溶液5份,进样分析,计算各共有峰相对峰面积及相对保留时间,其RSD值分别小于2.00%和1.00%,以第1份供试品的图谱数据作为参考,相似度RSD值小于1%,结果表明该方法重复性良好。
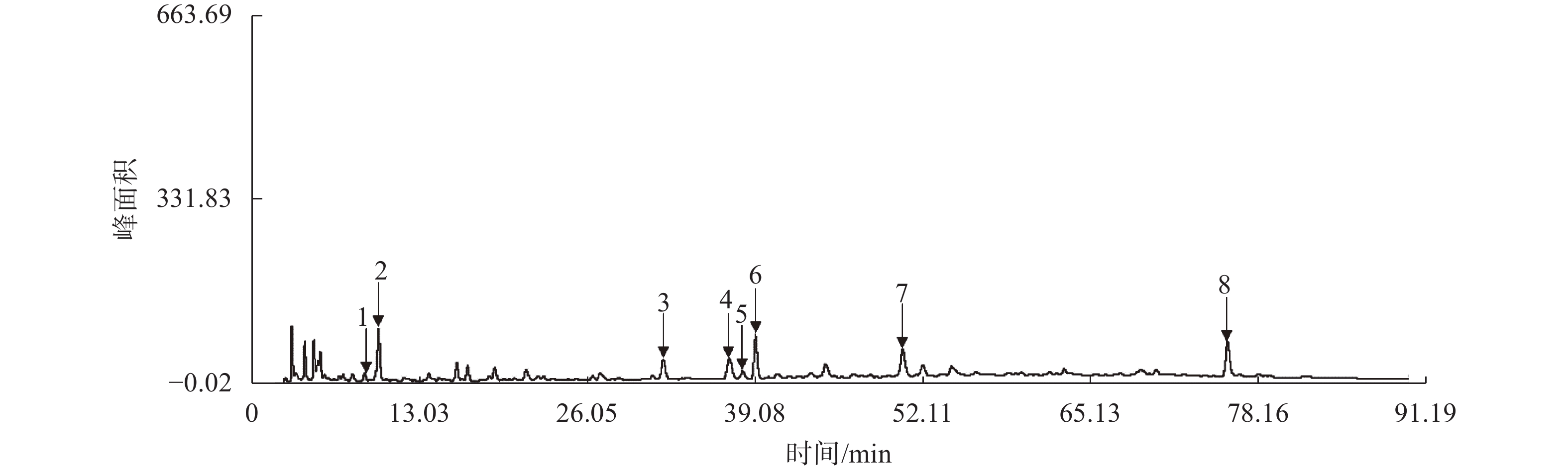
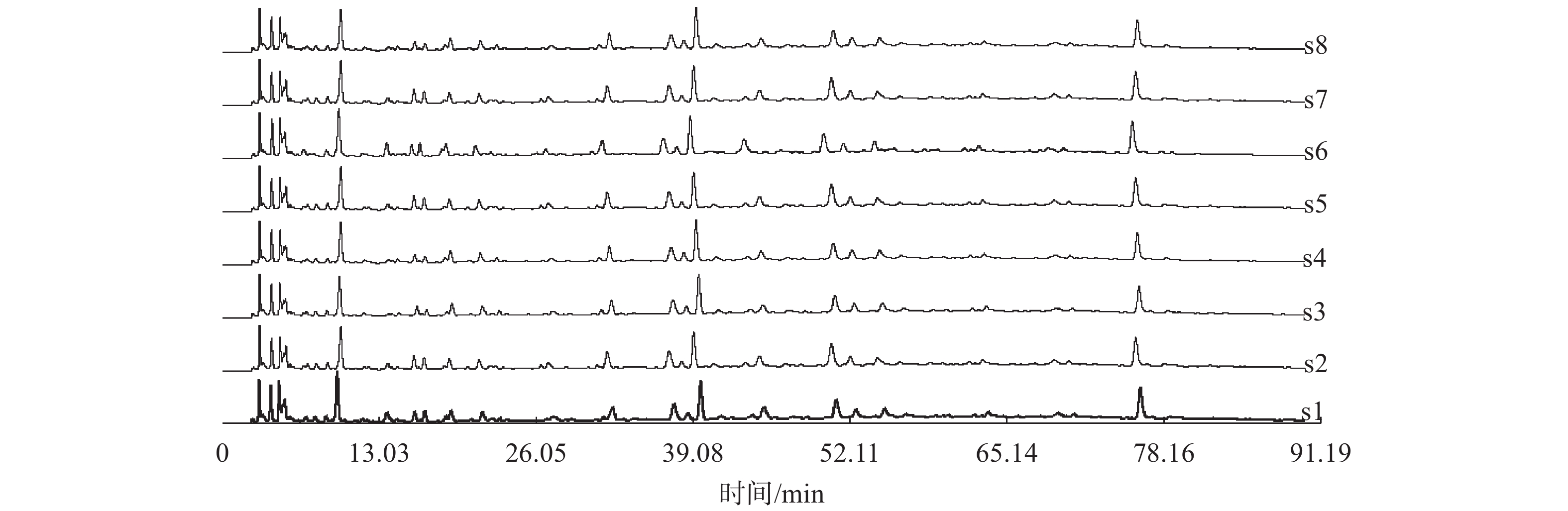
2.2.6 化学成分群图谱的构建取7批红花注射液,分别按照2.2.1项方法平行制备供试品溶液,按2.2.2项色谱方法测定。通过“中药色谱指纹图谱相似度评价系统A版”对数据进行分析[8],生成红花注射液指纹图谱的共有模式,确定了8个共有峰,如图2所示。7批红花注射液指纹图谱见图3。其中6号峰为紫丁香苷对照品,其液相色谱图见图4。
|
| 图 2 7批红花注射液指纹图谱的共有模式 Fig. 2 common pattern of fingerprint of 7 batches of safflower injection |
|
| 图 3 7批红花注射液指纹图谱 Fig. 3 fingerprint of 7 batches of safflower injection |
|
| 图 4 紫丁香苷对照品液相色谱图 Fig. 4 syringin reference substance liquid chromatogram |
2.3 红花注射液谱-效相关性分析 2.3.1 最优主成分数的确定
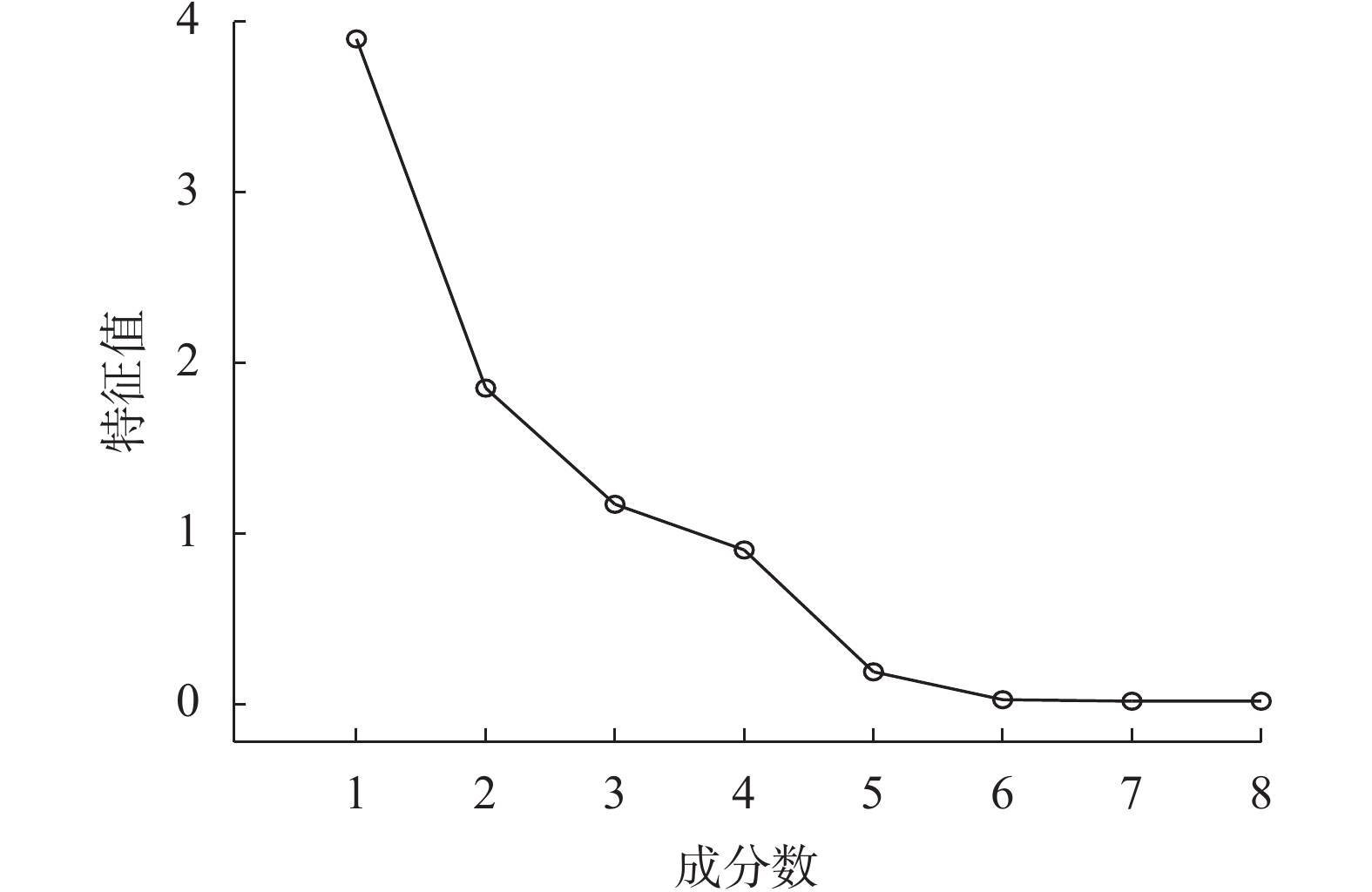
采用“Statistical Product and Service Solutions”(SPSS)中“Reduction”的“Factor”考察最优主成分数,最优主成分确定根据解释数据变异的比例、前几位主成分解释数据变异的总比例和陡坡图检验[9]。结果见表2和图5。由图、表可知,当主成分数为6时,前6位主成分解释数据变异的总比例为100%,且陡坡图在第6主成分之后趋于平缓;因此,该分析模型的最优主成分数为6。
| 成份 | 方差比例/
% |
累积比例/
% |
成份 | 方差比例/
% |
累积比例/
% |
|
| 1 | 48.893 | 48.893 | 5 | 2.105 | 99.887 | |
| 2 | 23.151 | 72.044 | 6 | 0.113 | 100.000 | |
| 3 | 14.550 | 86.594 | 7 | 1.050×10–14 | 100.000 | |
| 4 | 11.188 | 97.782 | 8 | −2.302×10–15 | 100.000 |
|
| 图 5 陡坡图检验 Fig. 5 test of steep slope |
2.3.2 主成分的确定
运用SPSS中“Correlate Bivariates”的“Pearson”分析各共有峰和抗凝血活性强弱的关系[10],根据两连续变量间相关的强弱确定主成分为峰2、3、4、6、7、8。各共有峰和抗凝血活性相关性强弱结果见表3。
| 共有峰 | Pearson相关性 | 共有峰 | Pearson相关性 | |
| 共有峰1 | 0.003 | 共有峰5 | –0.019 | |
| 共有峰2 | –0.381 | 共有峰6 | 0.413 | |
| 共有峰3 | –0.822 | 共有峰7 | –0.324 | |
| 共有峰4 | –0.342 | 共有峰8 | –0.090 |
2.3.3 谱-效相关数学模型的构建
运用SPSS中“Regression”的“Linear”,以峰面积为X,抗凝血活性为Y,采用多重线性回归,建立谱-效相关性评价模型,计算各共有峰的标准化回归系数,结果见表4。回归方程可以表示为:Y=9.696 158+ 0.006 147峰2 − 0.009 241峰 3− 0.016 023峰4 + 0.005 000峰6+ 0.006 512峰7 − 0.001 052峰8。纳入模型的6个自变量对抗凝血活性能力的影响均具有统计学意义( P<0.05)。
| 共有峰 | 标准化回归系数 | 共有峰 | 标准化回归系数 | |
| 共有峰2 | 0.006 147 | 共有峰6 | 0.005 000 | |
| 共有峰3 | –0.009 241 | 共有峰7 | 0.006 512 | |
| 共有峰4 | –0.016 023 | 共有峰8 | –0.001 052 |
2.4 红花注射液谱-效评价模型的验证
另取6批红花注射液,测定其抗凝血活性值,对已建立的谱-效评价模型的准确性和适用性进行验证,结果见表5。结果显示6批验证红花注射液抗凝血活性的模型预测值与实际测量值的相对误差在10%之内,结果表明建立的模型对红花注射液抗凝血活性值具有较好的评价效果。
| 样品批号 | 实测抗凝血活性值/
(U·mL–1) |
预测抗凝血活/
(U·mL–1) |
相对误差/
% |
| 180401 | 7.840 6 | 8.083 3 | 3.00 |
| 180402 | 8.177 3 | 8.262 1 | 1.03 |
| 180403 | 10.380 1 | 11.333 3 | 8.41 |
| 180404 | 10.911 0 | 11.699 6 | 6.74 |
| 170301 | 13.382 0 | 12.666 4 | 5.65 |
| 170314 | 14.931 5 | 15.145 8 | 1.42 |
3 结束语
红花注射液目前执行标准为WS3-B-3825-98-2012,其标准中仅对羟基红花黄色素A和总黄酮进行了定量测定。但是,中药的疗效并不是单一成分或几个成分的药效体现,而是众多成分的协同药效作用体现,因此,对单一成分或大类成分的质量控制,并不能控制中药的内在真实质量。
红花注射液具有抗凝血作用,本实验采用纤维蛋白平板法间接地反映其活血作用[11-12],从而达到对其药效进行量化的目的。实验结果显示紫丁香苷是红花注射液抗凝血效果的活性成分(相关性强弱为0.431,标准化回归系数为0.005),在所考察出的色谱条件下只能确定出一种成分,羟基红花黄色素A在确定的检验波长条件下峰面积较小,数据不适用于进行模型的构建,后续研究会结合UPLC-Q-TOF/MS法对其成分及其活性进行确认。
谱-效分析可在某种程度上阐明中药药效物质基础,建立反映中药内在质量的控制方法。但目前谱效分析研究多关注中药化学指纹图谱与体外活性的相关性,而中药在临床多需要服用,成分吸收入血后才能发挥预防治疗作用[13]。目前研究人员多采用HPLC法建立指纹图谱,而采用红外、紫外及近红外建立的指纹图谱可以反映更丰富的化学成分信息,因此在后续的研究中可用在体动物药效指标,结合各类指纹图谱(HPLC、红外、近红外及紫外图谱)数据建立模型,并进行相关性分析。
本实验在建立模型时运用了主成分分析、相关分析和回归分析3种分析方法,但每种分析方法都存在不足,如主成分分析通过数学降维的方法减少了分析变量,揭示了每组变量的主要因素,却不能给出2组变量间的相关性大小和建立数学模型,故常与其他统计学方法联合使用;相关分析法给出了每个色谱峰与药效指标的密切程度和变化方向,但却忽略了中药作用的整体性,不能解释各个色谱峰对药效的协同作用;因此,其谱-效研究分析方法的选择要根据研究数据进行具体选择。
| [1] |
刘静, 赵剑锋, 马双成, 等. HPLC法同时测定红花注射液中3种活性成分[J].
中成药, 2015, 37(11): 2426-2429.
|
| [2] |
赵剑锋, 刘静, 郭颖, 等. 红花注射液化学成分及其活性研究[J].
中国中药杂志, 2014, 39(16): 3102-3106.
|
| [3] |
徐玉玲, 伍月, 李鹏程, 等. 基于酶活性的复方地龙胶囊质量标准再评价研究[J].
中草药, 2017, 48(7): 1340-1343.
|
| [4] |
米慧娟, 王永香, 孟瑾, 等. 基于偏最小二乘法对金银花抗流感病毒谱-效相关性模型的探讨[J].
中国中药杂志, 2015, 40(23): 4650-4654.
|
| [5] |
秦昆明, 郑礼娟, 沈保家, 等. 谱效关系在中药研究中的应用及相关思考[J].
中国中药杂志, 2013, 38(1): 26-31.
|
| [6] |
王维亭, 郝春华, 赵专友, 等. 新型抗凝药物研发进展[J].
现代药物与临床, 2011, 2(1): 10-24.
|
| [7] |
刘涛, 谭清红, 王晓霞, 等. 基于酶活性的地龙质量标准再评价研究[J].
中药材, 2014, 37(9): 1535-1537.
|
| [8] |
米慧娟, 王永香, 吴云, 等. 基于化学成分群动态变化研究金银花药材在抗菌活性方面的质量优劣[J].
中草药, 2018, 49(7): 1677-1681.
|
| [9] |
李小胜, 陈珍珍. 如何正确应用SPSS软件做主成分分析[J].
统计研究, 2010, 27(8): 105-108.
DOI:10.3969/j.issn.1002-4565.2010.08.016 |
| [10] |
肖云芝, 于超, 刘朝勇, 等. 鳖甲药材指纹图谱与其抗肝纤维化作用的谱效关系研究[J].
中草药, 2014, 45(17): 2506-2510.
DOI:10.7501/j.issn.0253-2670.2014.17.015 |
| [11] |
郑国庆, 黄汉津, 王小同. 脑出血后凝血酶的作用与抗凝血酶治疗[J].
国外医学: 脑血管疾病分册, 2015, 13(3): 199-202.
|
| [12] |
谢平会, 董锐, 薛成玉, 等. 纤维蛋白平板法测定保健食品中纳豆激酶活[J].
中国卫生检验杂志, 2010, 20(7): 1658-1659.
|
| [13] |
曾令军, 林兵, 宋洪涛. 中药谱效关系研究进展及关键问题探讨[J].
中国中药杂志, 2015, 40(8): 1425-1432.
|
 2019, Vol. 45
2019, Vol. 45