文章信息
- 张廷贵, 邓其馨, 林艳, 周培琛, 张鼎方, 刘江生, 刘泽春, 许寒春
- ZHANG Tinggui, DENG Qixin, LIN Yan, ZHOU Peichen, ZHANG Dingfang, LIU Jiangsheng, LIU Zechun, XU Hanchun
- 液相色谱–串联质谱法同时测定烟草中的肌醇和奎尼酸
- Simultaneous determination of inositol and quinic acid in tobacco with liquid chromatography tandem mass spectrometry
- 中国测试, 2019, 45(7): 61-65
- CHINA MEASUREMENT & TEST, 2019, 45(7): 61-65
- http://dx.doi.org/10.11857/j.issn.1674-5124.201810096
-
文章历史
- 收稿日期: 2018-10-21
- 收到修改稿日期: 2018-11-26
肌醇和奎尼酸是广泛存在于中草药和烟草等植物中的天然含氧化合物[1]。肌醇是一种水溶性维生素,是动物、微生物的生长因子,其分子式为C6H12O6,化学结构式为1,2,3,4,5,6-环己六醇[2]。奎尼酸是植物在有氧呼吸过程中,经莽草酸途径形成的一种环状多羟基具有光学活性的化合物,其分子式为C6H7(OH)4COOH,化学结构式为1,3,4,5-四羟基环己烷-1-羧酸[3]。据报道肌醇和奎尼酸的含量与烟草品质和吃味密切相关,并且与主流烟气中的苯酚含量具有显著的相关性[4]。肌醇的检测方法有微生物法[5]、高碘酸钾氧化法[6]、高效液相色谱法[7]、气相色谱法、气相色谱质谱法[8-11]和液相色谱质谱法[12-14]等。其中微生物法前处理过程复杂,高碘酸钾氧化法误差较大,高效液相色谱法对于成分复杂样品分离效果差,而液相色谱质谱法灵敏度高,适用于多种基质中肌醇的检测[15]。刘泽春等[16]利用高效液相结合二极管阵列检测器测定了烟用香精香料中的奎尼酸,王有志等[17]利用高效液相色谱-电喷雾串联四极杆质谱法测定了双黄连粉针剂中的奎尼酸。由于奎尼酸的最大紫外吸收在201 nm且吸收很弱,因此HPLC/UV法不能检测到奎尼酸,而液相色谱质谱法选择性好、灵敏度高能很好的解决奎尼酸的检测问题。目前未见对烟草中奎尼酸检测方法报道。本文建立了同时测定肌醇和奎尼酸的液相色谱–串联质谱(LC-MS/MS)法,为烟草中肌醇和奎尼酸的分析测定和配方研究提供参考。
1 材料与方法 1.1 材料、试剂和仪器肌醇(纯度≥99%)、奎尼酸(纯度≥98%)、乙酸铵(纯度≥98%)、醋酸(色谱纯)、甲醇(色谱纯),购自百灵威科技有限公司。
Agilent 1290高效液相色谱仪(美国Agilent公司);三重四级杆质谱仪 QTRAP 5500(美国AB SCIEX公司);AG104电子天平(感量:0.000 1 g,瑞士Mettler Toledo公司);GFL3017型台式旋转振荡器(德国Gesellschaft公司);Human型超纯水系统(北京普析通用仪器有限责任公司);0.22 μm水相滤膜(美国Dionex公司)。
1.2 方 法 1.2.1 标准工作溶液配制分别准确称取0.1 g肌醇和奎尼酸于100 mL棕色容量瓶中,用0.1 mol/L乙酸铵水溶液溶解和定容,配制成1 mg/mL标准储备液。用0.1 mol/L乙酸铵水溶液将标准贮备液稀释为1.0 µg/mL、5.0 µg/mL、10.0 µg/mL、20.0 µg/mL、30.0 µg/mL、50.0 µg/mL系列浓度的肌醇和奎尼酸混合标准工作溶液。
1.2.2 样品溶液配制准确称取0.1 g烟末样品,置于150 mL磨口三角瓶中,准确加入50 mL 0.1 mol/L的乙酸铵水溶液,超声振荡30 min,经0.22 μm水相滤膜过滤后直接进样分析。
LC-MS/MS条件为:色谱柱:菲罗门Luna 5u C18色谱柱(150.0 mm×3.9 mm, 5 μm);流动相:A. 甲醇,B. 0.1% 醋酸水溶液;等度洗脱:0~5 min,1% A;流量:0.8 mL/min;柱温:40 ℃;进样体积:5 µL;离子源:电喷雾电离源(ESI);扫描方式:负离子扫描;检测方式:多反应监测(MRM);电喷雾电压:−4 500 V;离子源温度:550 ℃;辅助气(氮气)Gas1压力:413.70 kPa(60 psi);辅助气(氮气)Gas2压力:344.75 kPa(50 psi);去簇电压(DP):−40 V;定量离子对(m/z)和碰撞能见表1。
| 目标物 | 定量离子对 | 定性离子对 | 碰撞能/V |
| 肌醇 | 179/87 | 179/59 | −25 |
| 奎尼酸 | 191/93 | 191/85 | −20 |
| 注:1) 定量、定性离子对为母离子/子离子。 | |||
2 结果与讨论 2.1 色谱条件的选择
肌醇和奎尼酸的总离子流图(TIC)如图1所示,由图1可知,采用Luna 5u C18色谱柱对肌醇和奎尼酸进行分离时,分离度>2,色谱峰的峰形较好,且在实际样品的检测中没有出现杂峰干扰。此外,本文比较了纯水和0.1 %醋酸作为流动相。采用纯水作为流动相时,奎尼酸不出峰,且肌醇的峰强度较低,而采用0.1 %醋酸作为流动相时,色谱峰型较好,响应值较高。因此采用0.1 %醋酸作为流动相。

|
| 图 1 标准溶液与实际样品中肌醇和奎尼酸的TIC图 Fig. 1 TIC chromatogram of inositol and quinic acid in standard solution and samples |
2.2 质谱条件的选择
取一定量肌醇和奎尼酸的混合标准储备液,稀释100倍,得到肌醇和奎尼酸浓度均为10 μg/mL的混合标准溶液。采用流动注射法对该溶液直接进行MS分析,根据肌醇和奎尼酸的分子结构特征,选择电喷雾(ESI)离子源,在负离子模式下分别对肌醇和奎尼酸进行一级质谱分析,得到肌醇和奎尼酸的分子离子峰,选择合适的分子离子峰进行二级质谱碎片分析,得到子离子信息。结果见图2、图3。然后,以肌醇为目标物,固定其他参数,调节电喷雾电压为−3 500 V,−4 000 V,−4 500 V,响应丰度分别为1.69×105,1.75×105,1.83×105,因此选择电喷雾电压为−4 500 V,调节离子源温度为500 ℃,550 ℃,600 ℃,响应丰度分别为1.77×105,1.83×105,1.80×105,因此选择离子源温度为550 ℃。自动调节去簇电压从−10 V到−70 V,步长为5 V,响应丰度为−40 V时达到最大。奎尼酸的参数设定与肌醇一致。固定上述参数分别自动调节肌醇和奎尼酸的碰撞能,从−10 V到−70 V,步长为5 V,响应丰度分别在−25 V和−20 V时达到最大。因此确定上述各参数。
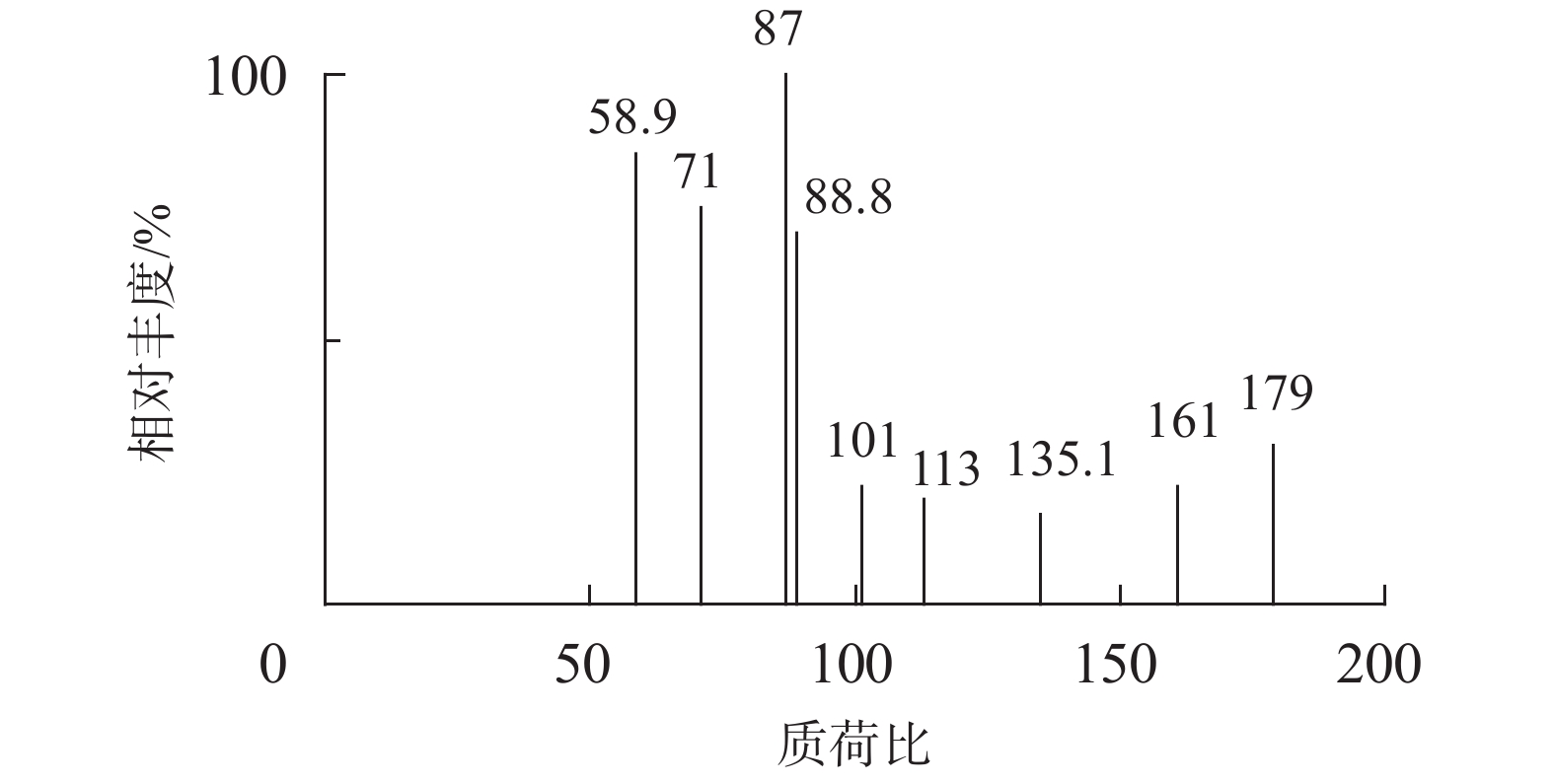
|
| 图 2 肌醇的质谱图 Fig. 2 Mass Spectrum of inositol |
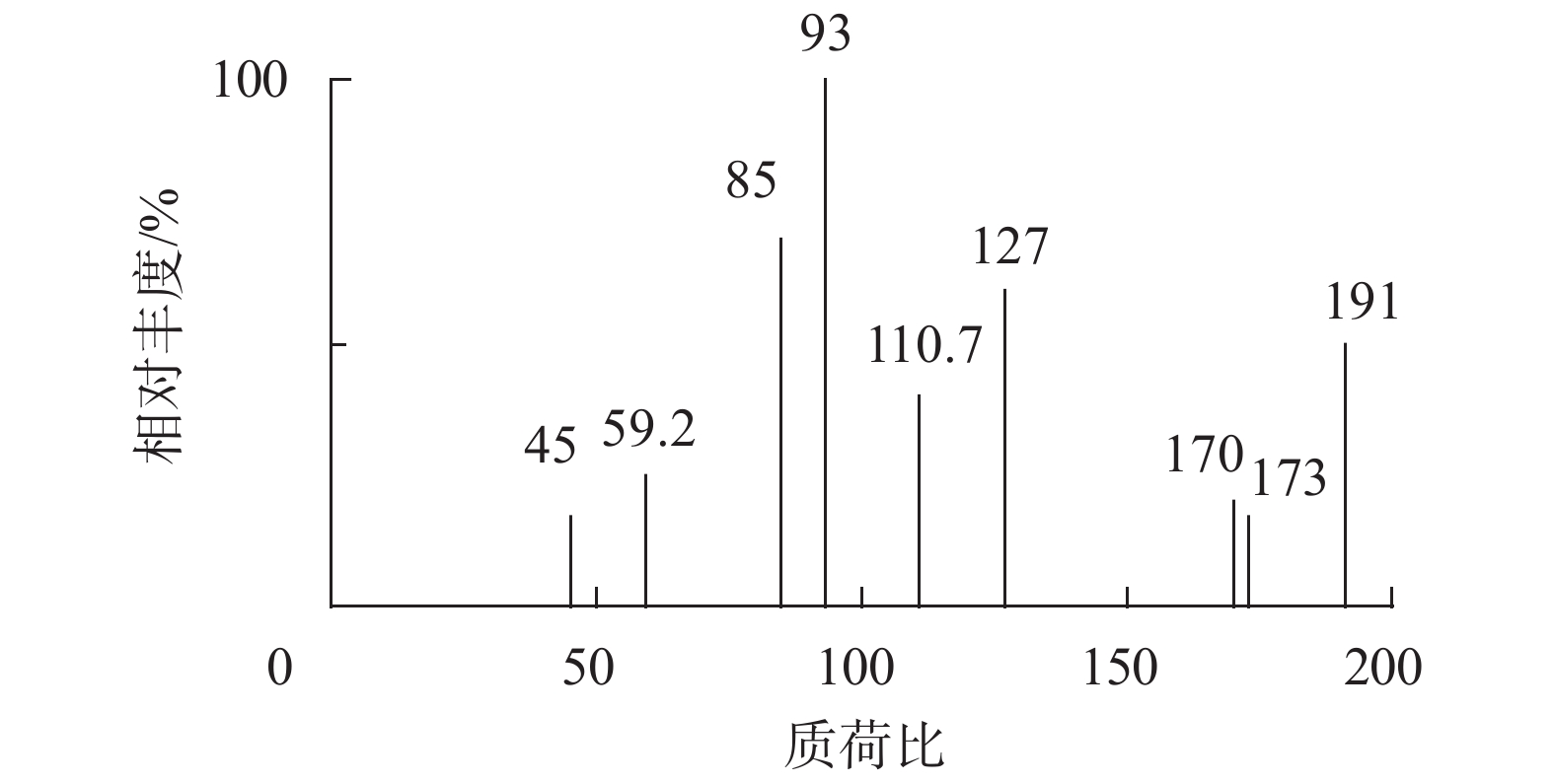
|
| 图 3 奎尼酸的质谱图 Fig. 3 Mass Spectrum of quinic acid |
2.3 前处理条件的确定
不同浓度乙酸铵水溶液萃取烟末样品的结果见图4。用纯水作为萃取溶剂的萃取效率较低,肌醇和奎尼酸的效率(以峰面积表示)约分别为0.09 mol/L乙酸铵体系效率的50%和45%;当乙酸铵浓度升高至0.09 mol/L、0.12 mol/L和0.15 mol/L时,烟草粉末提取液中肌醇和奎尼酸的浓度差异无统计学意义(P>0.05),因此选择0.09 mol/L乙酸铵为萃取溶剂。
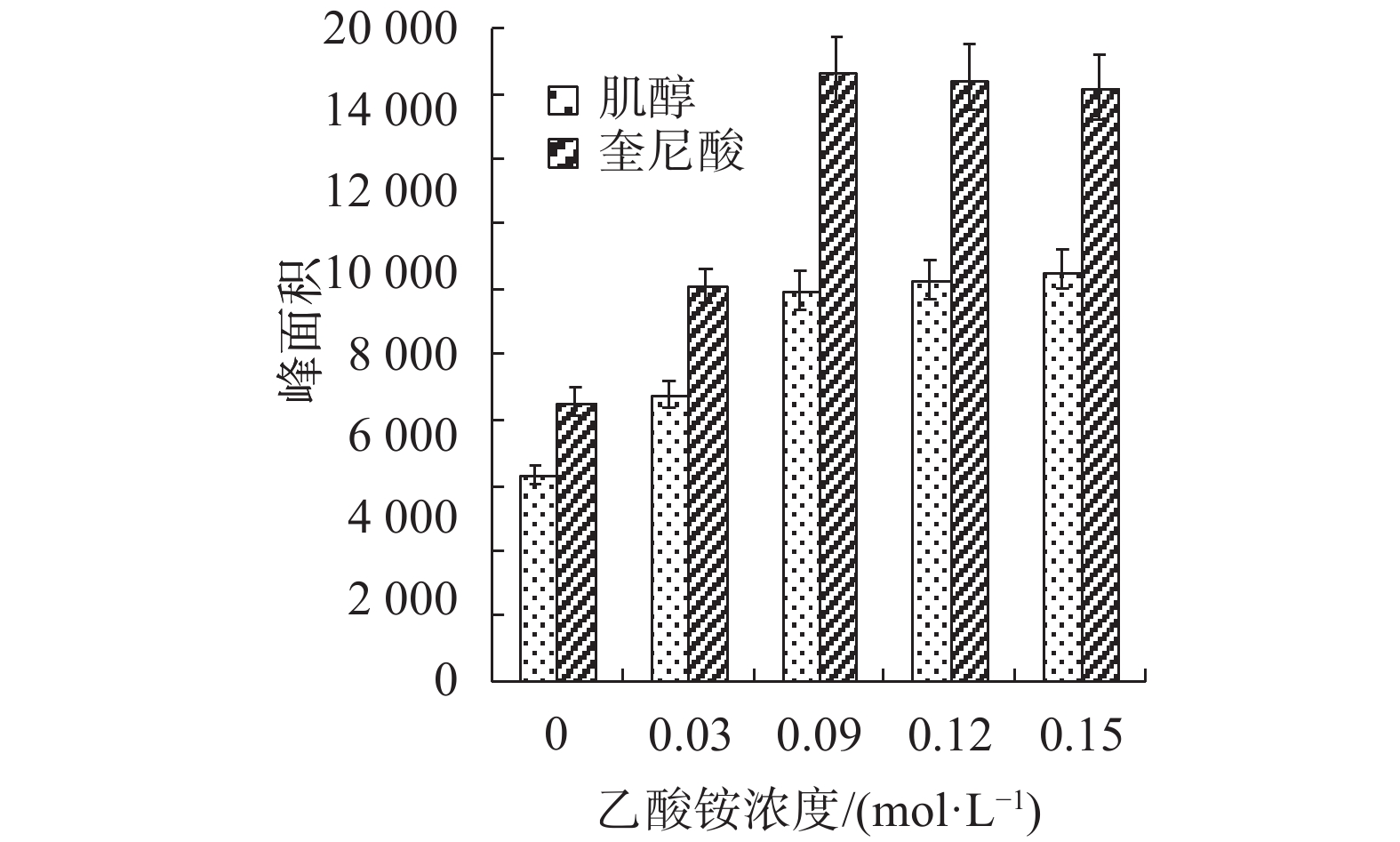
|
| 图 4 不同浓度乙酸铵萃取溶液的萃取效率 Fig. 4 Extraction efficiency of different concentrations of ammonium acetate extraction solution (by peak area) |
2.4 工作曲线
按照1.2节所述条件对样品进行LC-MS/MS分析,并以肌醇和奎尼酸的峰面积对其浓度值进行线性回归分析。空白样品连续测量11次,计算标准偏差,将3倍标准偏差记为方法的检出限,将10倍标准偏差记为方法的定量限,见表2。可见本方法肌醇在0.11~25 mg/g和奎尼酸在0.18~25 mg/g检测范围内线性良好,检出限和定量限能满足测定要求。
| 化合物 | 检测范围/(mg·g−1) | 回归方程 | r2 | 检出限/(mg·g−1) | 定量限/(mg·g−1) |
| 肌醇 | 0.11~25 | Y = 613X +1 059 | 0.999 2 | 0.035 | 0.11 |
| 奎尼酸 | 0.18~25 | Y = 1 469X +952 | 0.999 3 | 0.055 | 0.18 |
2.5 精密度和稳定性
精密度:在相同条件下,对同一样品平行测定6次。样品的肌醇含量结果为9.0,9.1,9.3,9.2,9.1,9.3 mg/g,相对标准偏差(RSD)为1.32 %;奎尼酸含量结果为5.1,5.1,5.3,5.2,5.2,5.4 mg/g,相对标准偏差(RSD)为2.24 %,表明方法的精密度高。
稳定性:在相同条件下,对同一样品的待测液,在室温分别存放0,12,24 h后进行测定,结果见图5。由图5可见,样品按照上述方法处理后,待测液中的肌醇和奎尼酸含量在24 h内稳定。
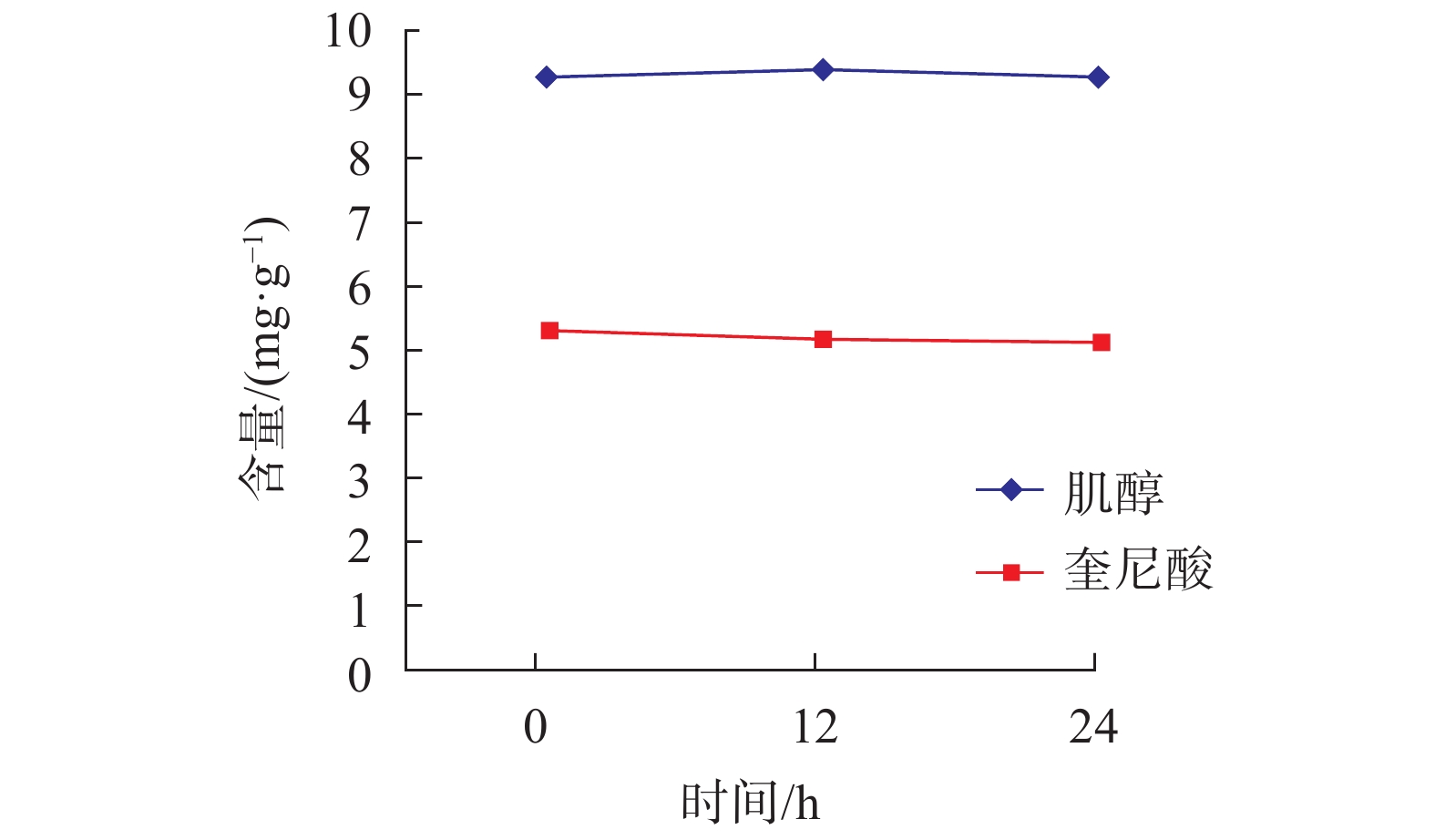
|
| 图 5 不同存放时间肌醇和奎尼酸的含量变化 Fig. 5 Changes at different storage times of inositol and quinic acid |
2.6 回收率
对同一烟末样品,在固体烟叶粉末中分别添加5.0 mg/g、10.0 mg/g、20.0 mg/g 3种浓度水平的肌醇标样和1.0 mg/g、5.0 mg/g、10.0 mg/g 3种浓度水平的奎尼酸标样,按照1.2节的方法对3个浓度水皮的样品重复测定6次,如表3所示。结果发现肌醇回收率在95.9%~98.6%之间,相对标准偏差(RSD)在1.4%~1.9%之间;奎尼酸回收率在95.2%~97.4%之间,相对标准偏差(RSD)在1.7%~2.1%之间。可见方法的回收率和重复性较好,可以满足样品的检测要求。
| 目标物 | 样品测定值/
(mg·g−1) |
理论加入量/
(mg·g−1) |
实际测量值/
(mg·g−1) |
回收率/
% |
RSD/
% |
| 肌醇 | 9.3 | 5.0 | 13.8 | 96.5 | 1.9 |
| 10.0 | 18.5 | 95.9 | 1.7 | ||
| 20.0 | 28.9 | 98.6 | 1.4 | ||
| 奎尼酸 | 5.2 | 1.0 | 5.9 | 95.2 | 2.1 |
| 5.0 | 9.8 | 96.1 | 2.0 | ||
| 10.0 | 14.8 | 97.4 | 1.7 |
2.7 实际样品分析结果
本文采用建立的液相色谱串联质谱法测定了不同产区不同部位单料烟肌醇和奎尼酸的含量。结果(见表4)表明:1)肌醇的含量在6.0~10.9 mg/g之间,奎尼酸的含量在1.1~6.7 mg/g之间。肌醇的含量高于奎尼酸的含量。2)1#、3#产地烟叶中肌醇和奎尼酸的含量上部烟高于下部烟,2#产地烟叶中肌醇和奎尼酸的含量下部烟高于上部烟。
| 样品 | 肌醇含量/(mg·g−1) | 奎尼酸含量/(mg·g−1) | |
| 产地1# | 上部 | 6.0 | 4.4 |
| 中部 | 7.3 | 6.7 | |
| 下部 | 5.9 | 1.1 | |
| 产地2# | 上部 | 6.1 | 1.1 |
| 中部 | 8.9 | 3.8 | |
| 下部 | 8.8 | 1.9 | |
| 产地3# | 上部 | 10.9 | 5.4 |
| 中部 | 10.2 | 5.9 | |
| 下部 | 8.3 | 4.6 | |
3 结束语
本研究主要考察了不同类型和浓度萃取液对烟草中肌醇和奎尼酸的提取效率,优化液相色谱–串联质谱检测方法中的色谱参数和质谱参数,建立了同时测定肌醇和奎尼酸的液相色谱–串联质谱(LC-MS/MS)法。实际样品测试结果表明该方法前处理简便,灵敏度和准确性高,重复性好,分析速度快,大大提高了检测效率,适合用于烟草中肌醇和奎尼酸含量的测定。
| [1] |
SERBAN C M, MICHAEL F D. Formation of dihydroxybenzenes in cigarette smoke[J].
Contributions to Tobacco Research, 2012, 25(2): 396-408.
|
| [2] |
杨保刚, 麦成华, 张辉. 气相色谱法测定化妆品中肌醇的含量[J].
香精香料化妆品, 2011(3): 33-34.
DOI:10.3969/j.issn.1000-4475.2011.03.009 |
| [3] |
刘礼兵, 徐琪寿. 奎尼酸的生物合成与应用[J].
生物技术通讯, 2005, 16(6): 693-695.
DOI:10.3969/j.issn.1009-0002.2005.06.033 |
| [4] |
SERBAN C M, MICHAEL F D. Analysis of quinicacid and of myo-Inositol in tobacco[J].
Contributions to Tobacco Research, 2012, 25(4): 499-506.
|
| [5] |
周敏, 陈亚波, 杨彤. 微生物法测定维生素功能饮料中的肌醇含量[J].
安徽农业科学, 2014, 42(7): 2123-2015.
DOI:10.3969/j.issn.0517-6611.2014.07.083 |
| [6] |
ANAB B, ROSA MJ, ROSAM A. Simultaneous determination of five1, 4-dihydropyridine sinpharmaceutical for mulations by high-performanceliquid chromatography ampere metric detection[J].
J Chromatogr A, 2004, 1031(1-2): 275-280.
DOI:10.1016/j.chroma.2003.11.019 |
| [7] |
刘珊珊, 吴琼珠. 高效液相色谱法测定赖氨肌醇维B12口服溶液中维生素B12及肌醇的含量[J].
药学与临床研究, 2007, 15(5): 371-374.
DOI:10.3969/j.issn.1673-7806.2007.05.010 |
| [8] |
高树刚, 申书昌, 王文波, 等. 气相色谱法测定大豆磷脂中磷脂酰肌醇[J].
理化检验-化学分册, 2007, 43(12): 1020-1021.
DOI:10.3321/j.issn:1001-4020.2007.12.009 |
| [9] |
食品安全国家标准食品中肌醇的测定: GB 5009.270-2016[S]. 北京: 中国质检出版社, 2016.
|
| [10] |
JIN G, SHI YF, XU CB, et al. Data on the optimization of a GC-MSprocedure for the determination of total plasmamyo-inositol[J].
Data Brief, 2016(8): 1040-1043.
DOI:10.1016/j.dib.2016.07.024 |
| [11] |
SUN S H, WANG H, XIE J P, et al. Simultaneous determination of rhamnose, xylitol, arabitol, fructose, glucose, inositol, sucrose, maltose in jujube(Zizyphus jujube Mill.) extract: comparison of HPLC-ELSD, LC-ESI-MS/MS and GC-MS[J].
Chem Centr J, 2016(10): 25.
DOI:10.1186/s13065-016-0171-2 |
| [12] |
PERELLO J, ISERN B, COSTA-BAUZA A, et al. Determination of myo-inositol inbiological samples by liquid chromatography-mass spectrometry[J].
JChromatogr B Anal Technol Biomed Lif Sci, 2004, 802(2): 367-370.
DOI:10.1016/j.jchromb.2003.12.005 |
| [13] |
KIM J, HOPPEL CL. Comprehensive approach to the quantitative analysisof mitochondrial phospholipids by HPLC-MS[J].
J Chromatog B-AnalTechnol Biomed Lif Sci, 2013(912): 105-114.
DOI:10.1016/j.jchromb.2012.10.036 |
| [14] |
JINHO S, JUNGMIN P, HAJUNG K, et al. Development rapid analyticalmethds for inositol as a trace componentby HPLC and LC-MS/MS ininfant formula[J].
Korean J Food Sci, 2015, 35(4): 466-472.
DOI:10.5851/kosfa.2015.35.4.466 |
| [15] |
房子舒, 黄传峰. 食品中肌醇的检测方法研究进展[J].
食品安全质量检测学报, 2019, 10(1): 14-18.
|
| [16] |
刘泽春, 黄朝章, 邓其馨, 等. 烟用香精香料中奎尼酸的测定[J].
香料香精化妆品, 2014, 10(4): 29-32.
DOI:10.3969/j.issn.1000-4475.2014.05.010 |
| [17] |
王有志, 罗奇志, 罗佳. 高效液相色谱-电喷雾串联四极杆质谱法测定双黄连粉针剂中奎尼酸的含量[J].
南方医科大学学报, 2010, 30(2): 401-402.
DOI:10.1360/972010-923 |
 2019, Vol. 45
2019, Vol. 45
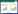


 ,
,