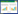文章信息
- 刘维, 周智威, 白婷, 刘保, 张国建, 李洋, 孙群
- LIU Wei, ZHOU Zhiwei, BAI Ting, LIU Bao, ZHANG Goujian, LI Yang, SUN Qun
- 外源ATP对羊肚菌采后理化性质和挥发性呈香物质的影响
- Effects of exogenous ATP on postharvest physicochemical properties and volatile aroma compounds in Morchella
- 中国测试, 2019, 45(8): 85-92
- CHINA MEASUREMENT & TEST, 2019, 45(8): 85-92
- http://dx.doi.org/10.11857/j.issn.1674-5124.2019020027
-
文章历史
- 收稿日期: 2019-02-18
- 收到修改稿日期: 2019-04-05
羊肚菌,隶属子囊菌亚门、盘菌纲、盘菌目、羊肚菌科、羊肚菌属,因其菌盖表面呈褶皱网状、状如羊肚而得名,主要分布在我国四川、青海、西藏、新疆等地。羊肚菌的营养价值和保健功效,使其商业化发展具有广泛的市场前景。近年来,羊肚菌全国人工种植规模剧增,从2012年的0.3万亩发展至2017年7万亩(1 亩=666.67 m2),年总产量接近2万吨,在未来的两三年内羊肚菌的鲜货销售量预计将达到每日15~20吨。
新鲜羊肚菌采收时表面坚挺,组织脆嫩,含水量高,表面没有保护结构,一般为白色或灰褐色。采后呼吸作用和新陈代谢仍然持续,水解酶和氧化酶酶活力升高,呼吸作用剧烈,在采收和运输过程中易受到机械损伤和微生物侵染,出现褐变、开伞、皱缩、软化等品质劣变现象。新鲜羊肚菌对温度极为敏感且具有特殊的中空结构,目前最常用的保鲜方法是4~10 ℃冷库储藏,货架期也只能延长至3~5 d;或者−20 ℃冷冻储藏,货架期可达到3个月以上,但是严重破坏羊肚菌的质构和风味。目前关于羊肚菌其他有效的保鲜技术的研究报道甚少。
能量平衡在食用菌采后成熟和衰老过程中非常重要。三磷酸腺苷 (adenosine triphosphate, ATP)是一种不稳定的高能化合物,是生物体内最直接的能量来源。有研究报道,外源ATP应用于龙眼、荔枝和绿豆芽[1-3]等果蔬保鲜,提高采后果蔬所需能荷,避免果蔬呼吸消耗引起的能量匮缺,有利于保持较佳的感官品质。果蔬采后会产生一系列的应激反应,导致活性氧(reactive oxygen species, ROS)的积累,ROS的清除需要ATP供能,ATP的缺乏可能会造成ROS持续性积累,进而使细胞膜氧化损伤,破坏膜脂结构的完整性,加快果蔬的衰老过程。采后果蔬补给外源ATP可维持能量平衡,降低呼吸速率和有机物的消耗[1]。外源ATP也可作为信号分子,激活NO/Ca2+等第二信使,调节细胞壁多糖、果胶降解等相关基因的表达[3-4],减缓采后果蔬的品质劣变速度。本文首次尝试将外源ATP应用到羊肚菌保鲜研究中,探究ATP处理对羊肚菌理化性质和挥发性呈香物质的影响,为进一步摸索羊肚菌保鲜方法提供理论基础。
1 材料和方法 1.1 材料人工种植梯棱羊肚菌Morchella importuna(购于四川省甘孜藏族自治州康定市);PE保鲜袋(购于家乐福超市);邻苯二酚、三氯乙酸、没食子酸、浓硫酸、硫酸亚铁、二甲酚橙、BHT、F-C试剂、氯化钠、过氧化氢、硫代巴比妥酸、三苯基膦(TPP)、乙二胺四乙酸二钠(EDTA-2Na)、甲醇、乙醇等试剂均为分析纯(购于成都鹏世达实验用品有限公司)。
1.2 仪器DK-8数显恒温水浴锅:上海跃进医疗器械有限公司;LabMaster neo控温台式水活度测定仪:瑞士NOVASINA公司;Micro21 R型高速冷冻离心机:美国Thermo Fisher Scientific 公司;AFZ-1002-U型超纯水仪:美国Aquapro公司;UV-2450紫外分光光度计:日本Shimadzu公司;岛津气质联用GC-MS QP2010:日本岛津公司。
1.3 试验方法 1.3.1 羊肚菌处理方法羊肚菌采收后用泥土覆盖和冰盒低温保存送至实验室,放在通风处让表面水分自然风干,24 h内处理样品。挑选大小一致品相优良的羊肚菌随机分成3组,分别用0.5 mmol/L ATP溶液和 0.7 mmol/L ATP溶液浸泡60 s为处理组,纯水浸泡60 s为对照组,每组3个平行,PE保鲜袋包装封口,4 ℃储藏。第1,5,9 天检测指标。
1.3.2 质构测定测定时将羊肚菌菌柄切成1 cm×1 cm的正方形样品。质构仪测定模式:质地多面分析(texture profile analysis, TPA);TPA 参数设置:测试速率2.0 mm/s,返回速度为4.5 mm/s,形变量85%,停隔时间5 s,数据收集频率100 Hz;探头类型:p/10直径10 mm 的圆柱形探头;测定指标:硬度、粘性、弹性、内聚性、咀嚼性和回复性。每个处理重复3次,求平均值。
1.3.3 水分活度测定方法室温下将羊肚菌柄和菌盖连接处切成小圆柱形,称取2.0 g。Lab Master neo控温台式水活度仪测定水分活度。
1.3.4 菌落计数采用平板菌落计数法检测羊肚菌储藏过程中的菌落总数,方法参考GB 4789.2-2016《食品微生物菌落总数的测定》。
1.3.5 多酚氧化酶活力测定方法多酚氧化酶(polyphenol oxidase, PPO)活力采用邻苯二酚比色法测定[5]。取羊肚菌1.0 g加入10 mL预冷的pH 6.8 0.05 mol/L磷酸缓冲液(含1% PVPP),充分研磨,10 000 r/min离心10 min,上清液备用。取试管A加入1.25 mL pH 6.8的磷酸缓冲液,在40 ℃温浴10 min,加入0.25 mL 40 ℃预热的样液,立即加入0.25 mL 20%的三氯乙酸溶液使酶失活,混匀,加入0.25 mL 0.3 mol/L邻苯二酚,8 000 r/min离心5 min,取上清,于波长410 nm处测定溶液吸光度A1,此为反应开始时的数值。同时,以磷酸缓冲溶液替代样液做相同处理,为空白对照。试管B加入1.25 mL pH 6.8的磷酸缓冲液,0.25 mL 0.3 mol/L邻苯二酚,摇匀,在40 ℃温浴10 min,加入0.25 mL预热的样液的同时开始计时,3 min后立即加人0.25 mL 20%的三氯乙酸溶液,8 000 r/min离心5 min,取上清,于波长410 nm处测溶液的吸光度A2,此为反应终止时的数值。其中A=A2−A1,以∆A变化0.01为一个酶活力单位计算酶活。
1.3.6 还原糖含量测定方法还原性糖含量测定采用3,5-二硝基水杨酸法[6]。取1.0 g羊肚菌加入10 mL 预冷的pH 6.8 0.05 mol/L磷酸缓冲液(含1% PVPP),充分研磨,80 ℃水浴30 min使还原糖浸出,10 000 r/min离心10 min,上清液备用。取0.5 mL样液,加入1.5 mL 3,5-二硝基水杨酸试剂,混匀,沸水水浴5 min,取出后立即放入盛有冷水的烧杯中冷却至室温,再以蒸馏水定容至10 mL,混匀,于波长540 nm处测定吸光度。以缓冲溶液替代样液做相同处理,作为空白对照。以0,0.2,0.4,0.6,0.8,1.0 mg/mL葡萄糖溶液绘制标准曲线,根据标准曲线计算还原性糖含量。
1.3.7 脂质氧化水平检测方法过氧化脂质(lipid peroxide, LPO)测定采用FOX 2法[7]。取1.0 g羊肚菌加入10 mL预冷的80%乙醇水溶液(含0.01% BHT),充分研磨,10 000 r/min离心10 min,上清液备用。取0.5 mL样液,分别加入0.1 mL 10 mmol/L TPP(+TPP)和甲醇(-TPP),涡旋振荡1 min,室温孵育30 min,最后加入1 mL FOX反应液,室温孵育30 min,于波长560 nm处吸光度值Abs560 [+TPP]和Abs560 [-TPP],Abs560 LOOH= Abs560 [-TPP]−Abs560 [+TPP]。以浓度为0,5,10,15,20,25 μmol/L H2O2绘制标准曲线,根据标准曲线计算样品LPO含量。
脂质氧化测定采用TBARS法[8]。取1.0 g羊肚菌加入10 mL预冷的TCA混合液(含7.5% TCA和0.1% EDTA-2Na),充分研磨,于55 ℃水浴30 min,10 000 r/min离心10 min,上清液备用。取1.0 mL样液,加入1.0 mL 0.02 mol/L硫代巴比妥酸溶液,混匀,于90 ℃水浴内反应20 min。以TCA混合液为空白调零,于532 nm波长处测定吸光值。
1.3.8 挥发性呈香物质检测顶空固相微萃取[9]条件:取2 g样品(切成2 mm厚度的片状)于20 mL样品瓶中密封,50 ℃平衡5 min,SPME萃取头顶空萃取40 min。色谱条件:进样口温度为250 ℃,不分流进样,解吸5 min。载气为高纯氦气,恒定流量1.0 mL/min。采用程序升温,初始温度40 ℃,保持1 min;然后以10 ℃/min的速度升至70 ℃,保持2 min;以3 ℃/min的速度升至105 ℃,维持1 min;最后以10 ℃/min的速度升至180 ℃,保持1 min。质谱条件:接口温度280 ℃,离子源温度230 ℃,发射电流70 A,扫描范围50~550 m/z。
2 结果与分析 2.1 羊肚菌外观变化图1是羊肚菌在储藏过程中的外观变化。由图可知羊肚菌在储藏过程中会发生不同程度的褐变,菌柄从白色逐渐变黄,0.7 mmol/L ATP处理组的褐变现象最为明显。第9天,对照组和0.7 mmol/L ATP处理组表面可以观察到少量白色菌丝,失去食用价值;在第11天,对照组和0.7 mmol/L ATP处理组表面的白色菌丝生长明显,0.5 mmol/L ATP处理组的表面有少量白色菌丝开始生长。从表观结果来看,0.5 mmol/L ATP可以延缓羊肚菌表面菌丝的生长。

|
| 图 1 羊肚菌在储藏过程中的外观变化 Fig. 1 Appearance changes of Morchella during storage |
2.2 羊肚菌质构变化
质地是羊肚菌在储藏过程中品质评价的重要指标。TPA是模拟人口腔咀嚼的过程,可以从硬度、内聚力、咀嚼性和弹性反应羊肚菌的质构特征。羊肚菌采后的新陈代谢仍在进行,蛋白、果胶和纤维素等细胞壁成分不断降解,水分因呼吸作用而消耗,导致细胞膨压降低,细胞结构松弛疏散,羊肚菌硬度、咀嚼性和弹性就会随之降低[10]。
表1列出了不同处理的羊肚菌在不同储藏时间硬度、咀嚼性和弹性的变化。结果显示,对照组的硬度和咀嚼性在整个储藏期间呈先降低后增加的趋势,而ATP处理组则是先增加后略微降低的趋势,该结果与杏鲍菇的品质变化趋势相似[11]。对照组和处理组羊肚菌的弹性在整个储藏期均没有发生显著性变化(P > 0.05),可能是因为羊肚菌本身的弹性较小,相应的变化也不明显。对照组第5天的硬度与初始相比显著降低( P < 0.05),可能是羊肚菌采后细胞内营养物质消耗,导致细胞结构强度降低,第9天对照组的硬度咀嚼性又增加是因为在储藏后期羊肚菌失水过多,子实体表面皱缩变硬。ATP处理组在第5天的硬度和咀嚼性显著高于对照组( P< 0.05),第9天仅有轻微降低,可能是外源ATP为采后羊肚菌提供新陈代谢所需的能量,避免子实体蛋白等营养物质的降解,同时还能促进果胶和纤维素的形成,从而维持羊肚菌正常的形态结构。其中,0.5 mmol/L ATP比0.7 mmol/L ATP更能提高羊肚菌的硬度和咀嚼性。总体来看,0.5 mmol/L ATP处理可以很好地维持羊肚菌质地特征。
| 储藏时间/d | 分组 | 质构指标 | ||
| 硬度 | 咀嚼性 | 弹性 | ||
| 0 | − | 10 558.28±941.31b | 3 578.69±612.76ab | 0.82±0.07a |
| 5 | Control | 8 229.16±1 220.72a | 3 127.29±722.85a | 0.78±0.07a |
| 0.5 mmol/L ATP | 13 725.31±958.50d | 4 799.90±840.04c | 0.74±0.09a | |
| 0.7 mmol/L ATP | 11 794.93±1 437.33bc | 4 314.29±891.70bc | 0.79±0.10a | |
| 9 | Control | 11 540.73±1 210.45bc | 3 389.00±845.30ab | 0.75±0.09a |
| 0.5 mmol/L ATP | 12 931.79±1 352.96cd | 4 234.67±681.80bc | 0.76±0.08a | |
| 0.7 mmol/L ATP | 1 145.88±1 452.78bc | 4 171.14±682.84bc | 0.80±0.07a | |
| 注:1)同一列的相同字母代表无显著性差异(P ≥ 0.05),不同字母代表有显著性差异(P < 0.05)。 | ||||
2.3 外源ATP对羊肚菌水分活度的影响
水分活度Aw值在食品保鲜研究中具有重要意义,可以用来预估和衡量食品中腐败微生物的繁殖、代谢、抗性及生存等能力,较低的水分活度可以提高食品的稳定性和防腐能力[12]。图2是羊肚菌在储存过程中的水分活度变化趋势。由于羊肚菌本身属于高水分食品(Aw=0.9~1.0),在储藏期水分活度的变化较小。在储藏末期ATP处理组的水分活度都显著低于对照组(P < 0.05),而0.5 mmol/L ATP处理组和 0.7 mmol/L ATP处理组之间没有显著差异( P > 0.05)。结果表明外源ATP处理可以显著抑制羊肚菌自由水含量的升高,在储藏过程中对微生物侵染羊肚菌有一定的抑制作用。
|
| 图 2 外源ATP对羊肚菌水分活度的影响 Fig. 2 Effect of exogenous ATP on water activity of Morchella |
2.4 外源ATP对羊肚菌微生物生长的影响
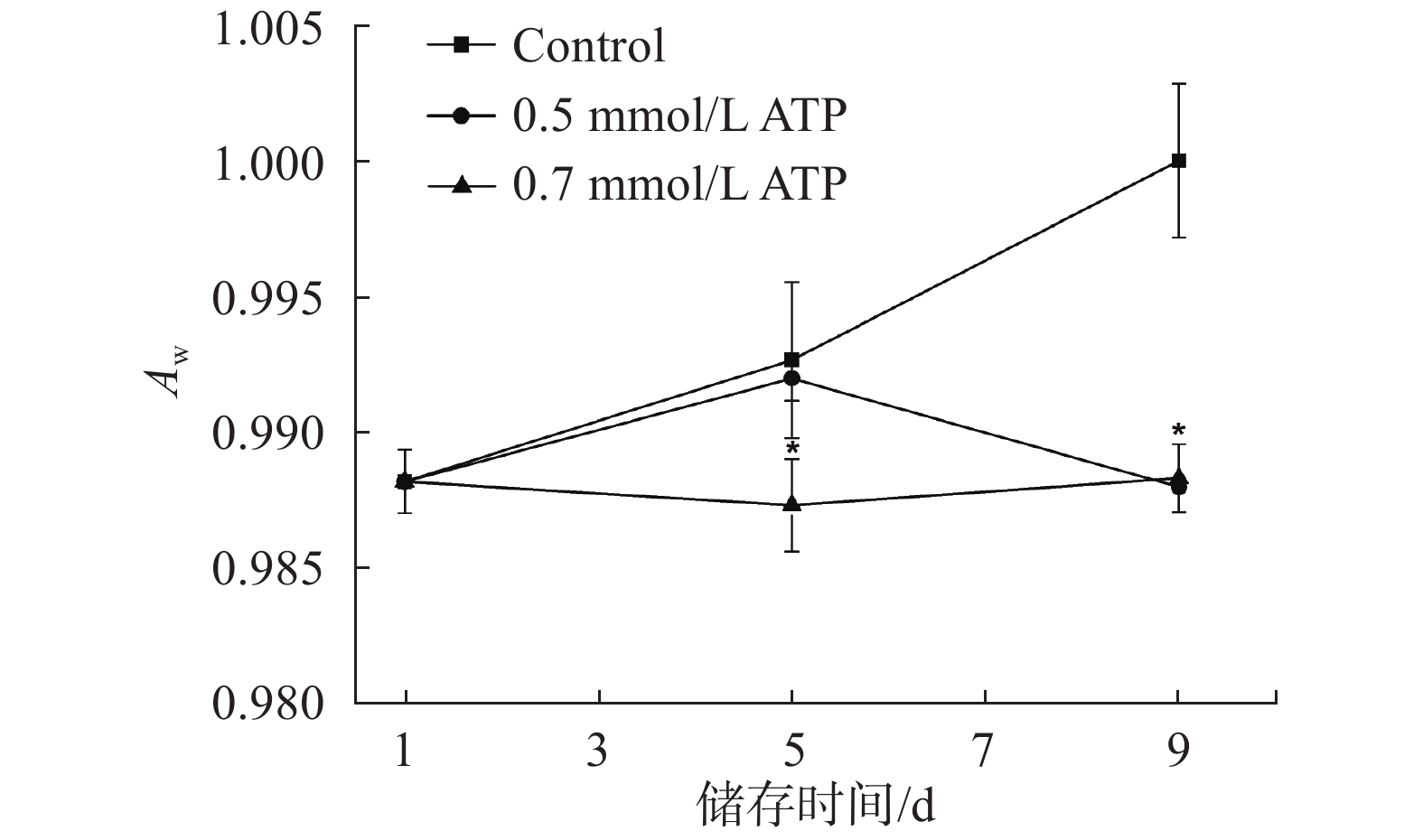
食用菌采后容易受到微生物侵染而腐败变质,微生物生长量是评价羊肚菌耐储性的重要指标。图3是储藏过程中对照组和处理组的微生物生长量变化趋势。储藏过程中,对照组和处理组在第0~5天菌落总数显著增加(P< 0.05),第5天和第9天,0.5 mmol/L ATP处理组的菌落总数都显著低于对照组(P < 0.05),0.7 mmol/L ATP处理组的菌落总数与对照相无显著差异( P > 0.05),表明0.5 mmol/L ATP处理可以抑制羊肚菌表面微生物的生长。
|
| 图 3 外源ATP对羊肚菌表面微生物生长的影响 Fig. 3 Effect of exogenous ATP on microbial growth of Morchella |
2.5 外源ATP对羊肚菌PPO酶活的影响
PPO是引起食用菌采后褐变的主要原因,抑制PPO酶活可延缓褐变速率,提升羊肚菌在保鲜贮藏期的品质[13]。图4是储藏过程中对照组和处理组的PPO酶活变化趋势。总体上看,对照组和处理组的 PPO的酶活随储藏时间的延长而提高。外源ATP处理组的PPO酶活在第5天和第9天均高于对照组,其中0.7 mmol/L ATP处理组显著高于对照组(P < 0.05),与拍照观察的结果相一致。0.5 mmol/LATP处理组PPO酶活在第5天与对照组没有显著性差异( P > 0.05),因此0.5 mmol/L ATP处理对PPO酶活没有显著抑制作用,但也不会显著提高PPO的酶活。

|
| 图 4 外源ATP对羊肚菌PPO酶活的影响 Fig. 4 Effect of exogenous ATP on PPO enzyme activity of Morchella |
2.6 外源ATP对羊肚菌还原性糖的影响
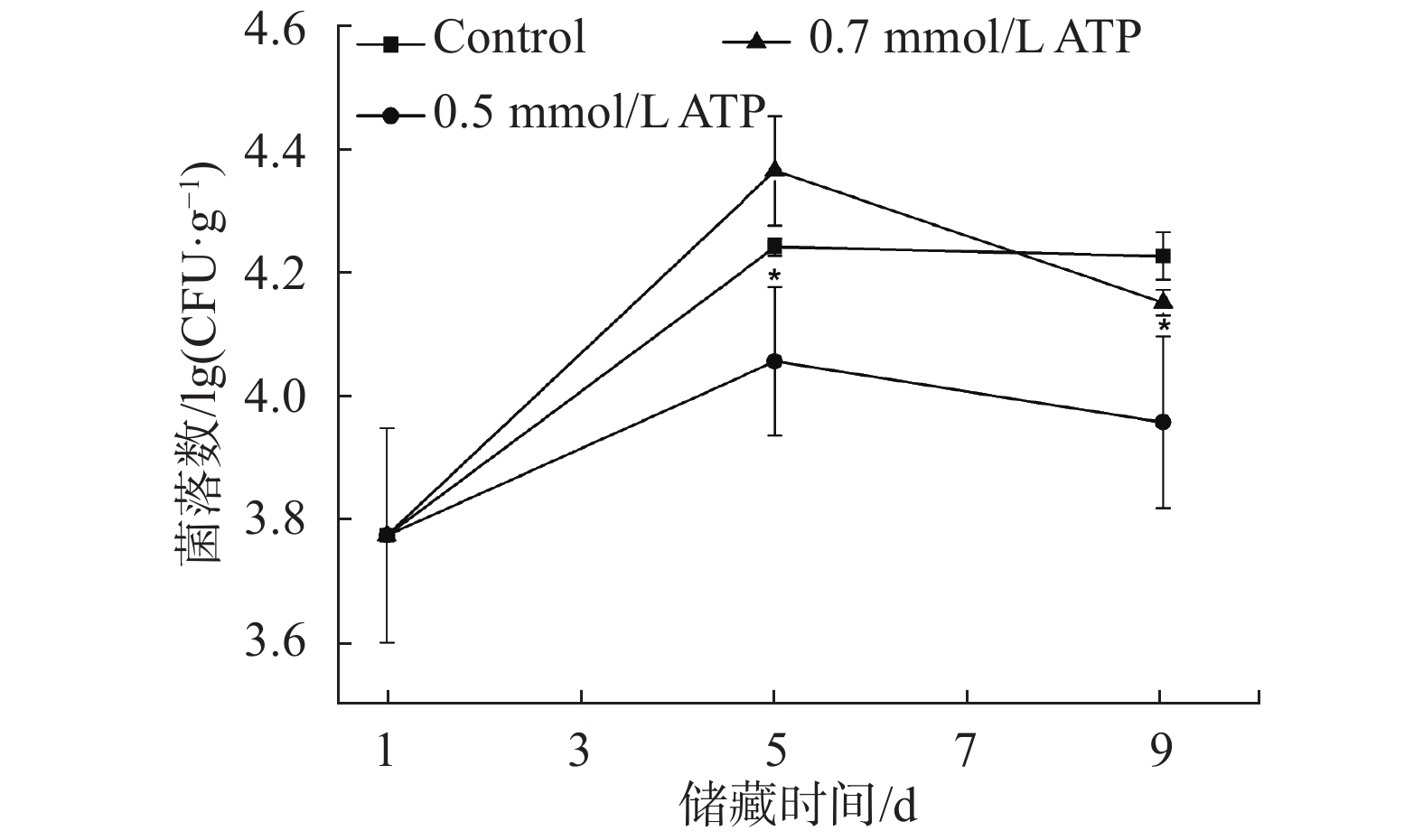
还原性糖是食用菌采后的主要呼吸底物,还原性糖的变化可间接表征其呼吸强度。图5是羊肚菌在储藏期间还原性糖的变化趋势。在储藏过程中,对照组的还原性糖含量先陡增后降低,该结果与双孢蘑菇和蟹味菇储藏期间还原糖变化趋势一致[14-15]。还原性糖含量上升的原因可能羊肚菌离开营养基质后,需要提高呼吸作用产生能量满足自身基础的新陈代谢,导致非可溶性糖的大量降解和还原糖的积累。0.5 mmol/L ATP 和0.7 mmol/L ATP处理组在第5 d还原性糖的含量分别降低了17%和18%,显著低于处理组(P < 0.05),0.5 mmol/L ATP处理组和0.7 mmol/L ATP处理组之间无显著差异( P > 0.05)。结果表明,ATP处理可有效减少还原性糖的积累,降低羊肚菌采后的呼吸作用,抑制非可溶性糖的大量降解。
|
| 图 5 外源ATP对羊肚菌还原性糖含量的影响 Fig. 5 Effect of exogenous ATP on reducing sugar content of Morchella |
2.7 外源ATP对羊肚菌脂质氧化的影响
脂质是细胞膜重要组成部分,采后果蔬的不饱和脂肪酸(PUFA)在活性氧自由基诱发下会进行一系列复杂的自由基降解反应过程,脂质过氧化物(lipid peroxide, LPO)是脂质氧化的初级产物[16]。果蔬采后活性氧代谢失调和积累会造成LPO值和TBARS值的提高,LPO值和TBARS值可以衡量果蔬膜脂的氧化程度,是果蔬采后衰老的指标。
图6是储藏过程中对照组和处理组的LPO值的变化趋势。在储存过程中,对照组和ATP处理组的LPO含量先增加后减少,因为LPO是脂质氧化初级产物且不稳定,在储藏后期会进一步氧化分解形成酮、醛、低级脂肪酸。在第5天,0.5 mmol/L ATP其LPO含量与对照组相比降低20%,对羊肚菌采后脂质过氧化初期过程有一定的抑制作用。图7是储藏过程中对照组和处理组的TBARS值的变化趋势。总体上看,对照组和ATP处理组的TBARS值随着储藏期的延长逐渐增加,0.7 mmol/L ATP处理组在第9天的TBARS值显著高于对照组,增加了羊肚菌采后的脂质氧化程度。0.5 mmol/L ATP处理组的TBARS值在第5天和第9天分别降低了27%和23%,显著低于对照组(P<0.05),减缓了羊肚菌采后的脂质氧化程度。综合LPO值和TBARS值两个脂质氧化指标的结果,表明0.5 mmol/L ATP处理可以显著降低羊肚菌采后储藏过程中的脂质氧化程度。

|
| 图 6 外源ATP对羊肚菌LPO值含量的影响 Fig. 6 Effect of exogenous ATP on LPO of Morchella |
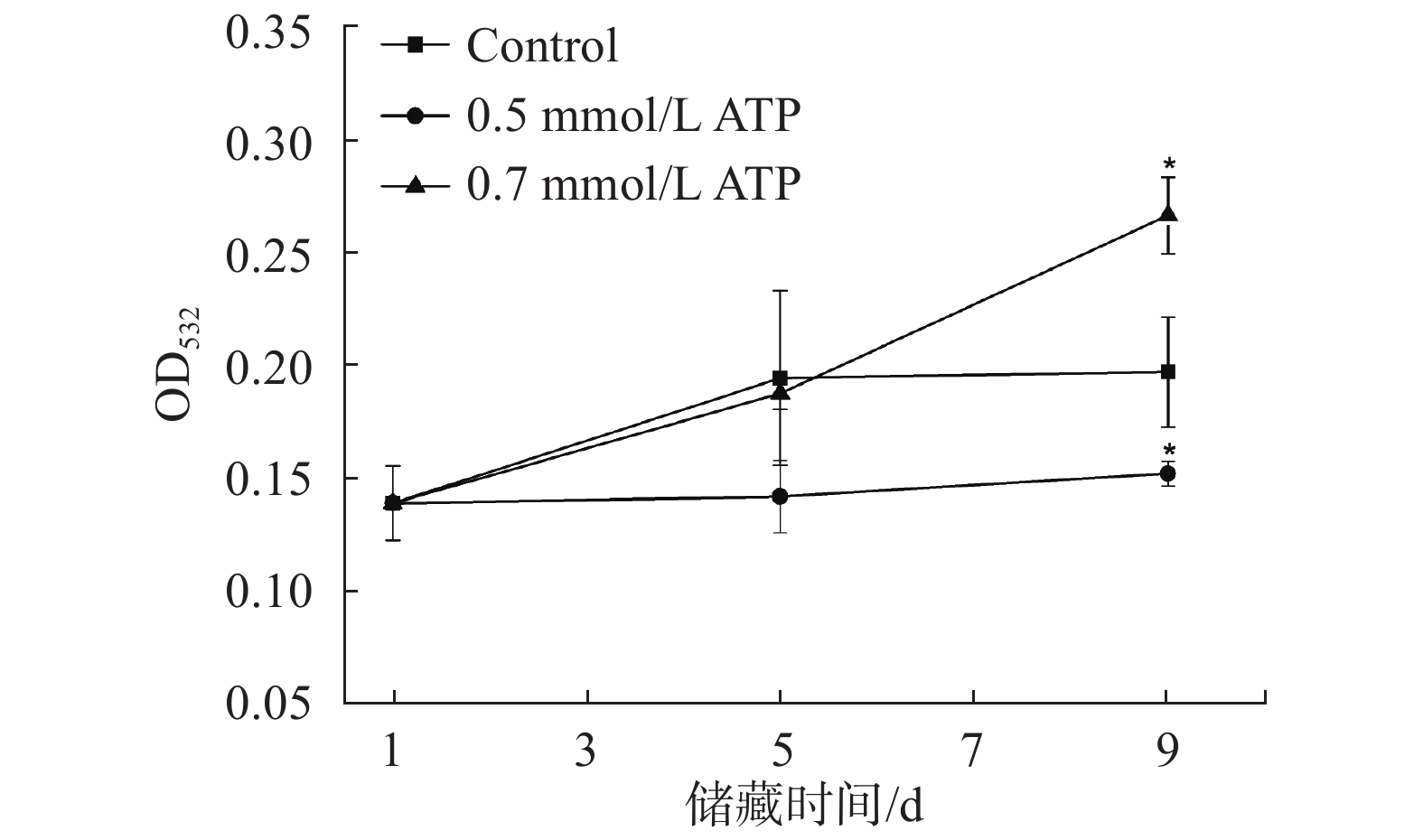
|
| 图 7 外源ATP对羊肚菌TBARS值的影响 Fig. 7 Effect of exogenous ATP on TBARS of Morchella |
2.8 外源ATP对羊肚菌挥发性呈香物质的影响
食用菌挥发性组分主要包括八碳化合物及其衍生物、萜烯类、含硫化合物以及醛酸酮酯类化合物等。以八碳化合物为主,醛酸酮酯类等挥发性成分与之互补。挥发性八碳化合物是亚油酸经脂肪氧化酶催化作用的产物,其中1-辛烯-3-醇,又称蘑菇醇,是大多数食用菌最重要的挥发性成分,具有非常浓烈的蘑菇风味[9]。
表2列出了对照组和处理组在储藏初期和末期挥发性呈香物质成分和含量的变化趋势。GC-MS结果显示羊肚菌的挥发性呈香物质主要集中在醛酮醇类化合物,其中报道过的有2-甲基丁醛(微带甜水果和巧克力似风味)、苯乙醛(水果的甜香气)、反-2-辛烯醛(水果和天然香料气味)、壬醛(油脂气味和甜橙气息)、1-辛烯-3-醇(蘑菇气味)、3-甲基苯甲醚[9, 17]。羊肚菌在储存初期和末期,对照组和ATP处理组的部分挥发性组分和含量发生明显变化。在储藏过程中,苯乙醛、壬醛、苯乙烯的含量明显降低,反-2-辛烯醛、1-辛烯-3-醇、反式-2-癸烯醇、1-辛烯-3-酮、1,2-二甲基-3-辛酮的含量明显增加。在第9天,ATP处理组与对照组相比,主要的挥发性组分种类保持一致,部分特征挥发性组分如2-甲基丁醛、苯乙醛、反-2-辛烯醛、1-辛烯-3-醇、1,2-二甲基-3-辛酮的含量都高于对照组,其中0.7 mmol/L ATP处理组还新检出2-甲基丁醇、异戊醇等对羊肚菌香味有贡献的组分。ATP处理羊肚菌可以较好地稳定特征性挥发组分的种类和含量,甚至还可以明显提高部分对羊肚菌香味有贡献的组分的含量,可以较好地保持羊肚菌的香味特征。
| 类别 | 名称 | 峰面积/% | |||
| 1 d | 9 d | ||||
| Control | 0.5 mmol/L ATP | 0.7 mmol/L ATP | |||
| 醛类 | 2-甲基丁醛 | 1.01±0.30 | 0.69±0.09 | 0.93±0.10 | 0.94±0.21 |
| 苯乙醛 | 19.09±5.47 | 1.14±0.27 | 1.47±0.12 | 1.93±0.37 | |
| 反-2-辛烯醛 | 0.31±0.02 | 3.86±0.57 | 9.69±2.11 | 4.60±1.21 | |
| 壬醛 | 0.42±0.46 | 0.07±0.02 | 0.05±0.00 | 0.07±0.01 | |
| 丙醛 | n.d. | 0.08 | 0.12±0.02 | n.d. | |
| 醇类 | 2-甲基丁醇 | n.d. | n.d. | n.d. | 0.07±0.01 |
| 异戊醇 | n.d. | n.d. | n.d. | 0.12±0.04 | |
| 1-辛烯-3-醇 | 6.48±0.04 | 61.48±3.36 | 73.34±2.35 | 66.39±6.75 | |
| 反式-2-辛烯-1-醇 | 0.53±0.22 | 1.47±0.60 | 0.26±0.11 | 0.45±0.26 | |
| 反式-2-癸烯醇 | n.d. | 0.24±0.03 | 0.28±0.20 | 0.22±0.16 | |
| 1-环丙基乙醇 | n.d. | n.d. | n.d. | n.d. | |
| 酮类 | 1-辛烯-3-酮 | n.d. | 1.47±0.00 | 1.55±0.00 | 1.31±0.08 |
| 1,2-二甲基-3-辛酮 | 2.12±1.84 | 3.89±1.82 | 4.15±2.02 | 6.71±4.29 | |
| 环辛酮 | n.d. | n.d. | 0.60±0.70 | n.d. | |
| 其他 | 苯乙烯 | 0.05 | n.d. | n.d. | n.d. |
| 3,5- 5-三甲基-2-己烯 | n.d. | 0.11±0.01 | 0.28±0.11 | 0.24±0.12 | |
| (E)-9-十八烯 | 0.15±0.02 | n.d. | n.d. | n.d. | |
| 3-甲基苯甲醚 | 0.47 | n.d. | n.d. | n.d. | |
| 4-庚胺 | 0.06±0.02 | 0.07±0.01 | 0.05±0.00 | 0.07±0.03 | |
| 2-甲基庚烷 | 7.17±5.38 | 1.03±0.04 | 1.10±0.08 | 1.01±0.05 | |
| 2-(2-庚炔氧基)四氢-2H-吡喃 | n.d. | 0.51±0.11 | n.d. | n.d. | |
| 壬酸 | 0.90±0.92 | n.d. | n.d. | n.d. | |
| 注:1)n.d.表示未检出。 | |||||
3 讨 论
能量匮乏是果蔬采后衰老腐烂的关键因素。王晓艳[18]研究发现在龙眼果实的自溶过程中,龙眼果肉与能量代谢相关蛋白酶的基因表达量全部下调,这类酶主要参与糖酵解三羧酸循环和磷酸戊糖等途径,表明ATP供应不足会加重果实衰老进程和自溶速度。0.5 mmol/L 的ATP处理使羊肚菌在储藏期间保持较低的微生物生长量,延缓羊肚菌表面白色菌丝的生长,抑制非可溶性糖的降解,降低呼吸速率。该结果与陈梦茵等[19]的报道较为一致,用致病菌拟茎点霉侵染ATP浸泡后的龙眼果实,发现ATP处理抑制了COX(环氧化酶)、AAO(抗坏血酸氧化酶)、PPO(多酚氧化酶)等呼吸末端氧化酶活性,降低龙眼病情指数、果实褐变指数和呼吸速率。Chen等[1]的结果也表明ATP处理后的龙眼有更高的商业接收率和更低的失重率,可以显著提高货架期龙眼的感官品质。
0.5 mmol/L ATP处理明显降低了羊肚菌的脂质氧化程度,可能是因为外源ATP及时供能或提高抗氧化酶活性而促进羊肚菌细胞清除应激损伤产生的ROS,如超氧阴离子自由基(O2−·)、过氧化氢(H2O2)、羟自由基(OH·)等,从而降低了羊肚菌膜脂氧化损伤的程度。Chen等[1]用外源ATP浸泡处理绿豆芽,发现绿豆芽的H2O2含量在整个货架期都始终低于对照组,POD(过氧化物酶)和SOD(超氧化物歧化酶)的活性也显著提高。Yi等[2]用外源ATP处理荔枝,荔枝的游离脂肪酸含量随着货架期的延长逐渐增加,特别是饱和脂肪酸,而外源ATP可以延缓荔枝饱和脂肪酸的产生速度,可能是通过抑制脂酶或脂质氧化酶活性从而降低脂质水解和氧化程度。
ATP处理可以进一步提高了羊肚菌关键挥发性呈香物质的含量且无剂量差异,如2-甲基丁醛、苯乙醛、反-2-辛烯醛、1-辛烯-3-醇、1,2-二甲基-3-辛酮,目前还未见相关报道,猜想可能是因为ATP处理可以使羊肚菌在一段时间内正常生长并成熟,使羊肚菌的香气可以更加浓郁,具体的机制还有待研究。不过在其他食用菌保鲜研究中也有类似的报道,Culleré等[20]利用辐照对块菌进行保鲜处理,发现1.5 K电子束辐照可以提高3-甲基丁醇等块菌特征香气物质的含量,还发现电子束辐照比γ射线对块菌香气的影响更大,且表现为积极的影响。此外,研究报道ATP处理都能显著缓解龙眼和绿豆芽[1, 3]的褐变现象,但对羊肚菌的褐变并没有表现出明显的抑制效果。
4 结束语0.5 mmol/L ATP可以缓解羊肚菌的脂质氧化程度,很好地保持羊肚菌采后储藏过程中的理化性质和香味特征,在羊肚菌保鲜研究中具有一定的应用潜力。褐变是影响食用菌品质的主要原因,是食用菌保鲜的重要指标,0.5 mmol/L ATP在本文结果中不能有效缓解羊肚菌褐变现象。因此,在后期研究中有必要尝试用其他方法联用,以期摸索出一种安全、有效、方便的羊肚菌保鲜方法,拓宽羊肚菌的销路,促进其商业发展。
| [1] |
CHEN M, LIN H, ZHANG S, et al. Effects of adenosine triphosphate (ATP) treatment on postharvest physiology, quality and storage behavior of longan fruit[J].
Food & Bioprocess Technology, 2015, 8(5): 971-982.
|
| [2] |
YI C, JIANG Y, SHI J, et al. Effect of adenosine triphosphate on changes of fatty acids in harvested litchi fruit infected by Peronophythora litchii[J].
Postharvest Biology & Technology, 2009, 54(3): 159-164.
|
| [3] |
CHEN L, ZHOU Y, HE Z, et al. Effect of exogenous ATP on the postharvest properties and pectin degradation of mung bean sprouts (Vigna radiata)[J].
Food Chem, 2018, 251: 9-17.
DOI:10.1016/j.foodchem.2018.01.061 |
| [4] |
HUI L, CHEN F, LAI S, et al. Effects of calcium treatment and low temperature storage on cell wall polysaccharide nanostructures and quality of postharvest apricot (Prunus armeniaca)[J].
Food Chemistry, 2017, 225: 87-97.
DOI:10.1016/j.foodchem.2017.01.008 |
| [5] |
黄赫雁, 韩春然, 李煜, 等. 香菇多酚氧化酶活性测定方法的改进[J].
农产品加工, 2016(11): 32-37.
|
| [6] |
姜天甲. 主要食用菌采后品质劣变机理及调控技术研究[D]. 杭州: 浙江大学, 2010.
|
| [7] |
DELONG J M, PRANGE R K, HODGES D M, et al. Using a modified ferrous oxidation xylenol orange (FOX) assay for detection of lipid hydroperoxides in plant tissue[J].
Journal of Agricultural and Food Chemistry, 2002, 50(2): 248-254.
DOI:10.1021/jf0106695 |
| [8] |
HODGES D M, DELONG J M, FORNEY C F, et al. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J].
Planta, 1999, 207: 604-611.
DOI:10.1007/s004250050524 |
| [9] |
李小林, 陈诚, 黄羽佳, 等. 顶空固相微萃取-气质联用分析4种野生食用菌干品的挥发性香气成分[J].
食品与发酵工业, 2015, 41(9): 174-180.
|
| [10] |
尹敏. 聚乳酸纳米复合材料对食用菌保鲜效果的研究[D]. 昆明: 昆明理工大学, 2017.
|
| [11] |
石建春, 冯翠萍, 常明昌, 等. 不同包装材料对货架期杏鲍菇贮藏品质的影响[J].
食品工业, 2017(5): 102-105.
|
| [12] |
李琳, 万素英. 水分活度(Aw)与食品防腐[J].
中国食品添加剂, 2000(4): 33-37.
|
| [13] |
张琦, 吴素蕊, 樊建, 等. 黑脉羊肚菌多酚氧化酶特性研究[J].
食品工业科技, 2013, 34(15): 124-126.
|
| [14] |
王耀松. 蟹味菇采后生理及贮藏保鲜技术研究[D]. 西北农林科技大学, 2007.
|
| [15] |
刘吟, 李成华, 吴关威, 等. 双孢蘑菇子实体采后褐变及相关生化变化研究[J].
中国食用菌, 2010, 29(3): 48-51.
DOI:10.3969/j.issn.1003-8310.2010.03.017 |
| [16] |
孙月娥, 王卫东. 国内外脂质氧化检测方法研究进展[J].
中国粮油学报, 2010, 25(9): 123-128.
|
| [17] |
TAŞKIN H. Detection of volatile aroma compounds of Morchella by headspace gas chromatography mass spectrometry (HS-GC/MS)[J].
Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2013, 41(1): 122-125.
DOI:10.15835/nbha4118344 |
| [18] |
王晓艳. 龙眼(Dimocarpus longan Lour.)采后果肉自溶发生相关蛋白的分离鉴定及功能分析[D]. 福州: 福建农林大学, 2013.
|
| [19] |
陈梦茵, 林河通, 洪延康, 等. DNP和ATP对Phomopsis longanae Chi侵染的龙眼果实病害发生、能荷状态和呼吸代谢的调控[J].
现代食品科技, 2015, 31(5): 49-58.
|
| [20] |
CULLERÉ L, FERREIRA V, VENTURINI M E, et al. Evaluation of gamma and electron-beam irradiation on the aromatic profile of black truffle (Tuber melanosporum) and summer truffle (Tuber aestivum)[J].
Innovative Food Science & Emerging Technologies, 2012, 13(1): 151-157.
|
 2019, Vol. 45
2019, Vol. 45