文章信息
- 李春, 高运华, 王治栋, 黄文胜
- LI Chun, GAO Yunhua, WANG Zhidong, HUANG Wensheng
- 基于核酸检测的虾过敏源标准物质研究
- Study on reference materials of shrimp allergen based on nucleic acid detection
- 中国测试, 2019, 45(9): 49-53
- CHINA MEASUREMENT & TEST, 2019, 45(9): 49-53
- http://dx.doi.org/10.11857/j.issn.1674-5124.2019020015
-
文章历史
- 收稿日期: 2019-02-15
- 收到修改稿日期: 2019-03-31
2. 中国检验检疫科学研究院,北京 100176
2. Chinese Academy of Inspection and Quarantine, Beijing 100176, China
为有效预防和控制食物过敏给人类健康带来的危害,食物过敏源的检测、诊断以及治疗已成为国内外研究的热点[1-3]。检测过敏源成分的方法主要有两类,一是检测过敏源蛋白质,二是检测过敏源基因残留[4-6]。检测过敏源蛋白质方法直接,但是当过敏蛋白含量极低时,很容易被食品的基质所掩盖,同时不同过敏源之间有部分相同的抗原决定簇会发生一定的交叉反应,容易造成检测的误差[7-8]。检测过敏源基因残留方法并不直接针对食品中的过敏源进行检测,而是通过分析食品中是否还有该过敏源物种的基因成分,从而推测该产品是否含有该物种的过敏源[9-12]。我国发布过系列过敏源PCR检测方法标准,该标准方法基于扩增反应,灵敏度非常高,痕量的物种残留即可检出,为基于基因残留检测的过敏源检测提供了方法标准[13-14]。但是,非常高的灵敏度,也使PCR检测方法在某些产品上会出现假阳性,如大豆油作为大豆的油脂一般不含有大豆蛋白过敏源,但PCR方法也可以检测出大豆基因的物种残留,给出阳性判定。因此,检测过敏源蛋白质和检测过敏源基因残留两种方法均有局限性,而法定的、具有特定量值的过敏源标准物质是过敏源成分检测结果准确有效保证。
食物过敏标准物质是解决食物过敏检测问题的关键材料之一。美国国家标准与技术研究院(NIST) 研制了8种过敏性食物标准物质;欧盟资助的EuroPrevall 项目构建了一个食物过敏源信息的数据库,而CREATE 项目则首次证实重组花粉过敏源rBet v1 可作为天然花粉过敏源Bet v1的候选标准物质,为开发重组食物过敏源标准物质提供了一种借鉴。国内外基于过敏源残留基因检测的技术标准方法越来越多,但相对应的标准物质现在还不多,世界各国正积极研制相对应的标准物质。我国食物过敏源蛋白和核酸检测的标准物质研究正积极开展,食物过敏源标准物质将为我国食物过敏源蛋白和核酸检测结果的有效性、法制性和溯源性提供强有力的物质和技术支撑。本文以最常食用的虾为候选物,以胡萝卜为本底,用数字PCR方法测定虾和葫芦卜特异基因拷贝数,重量法配制1%水平的虾-胡萝卜基因组标准物质,利用数字PCR和荧光定量PCR方法对配制的标准物质特性量值进行了验证,为基于核酸检测的食物过敏源标准物质的研制提供参考。
1 实验部分 1.1 仪器设备冷冻干燥仪:热电,Biosafer-18D,(美国);数字PCR仪:Bio-Rad QX 200(美国);实时荧光定量PCR仪:LightCycler 480 II(美国);电子天平:梅特勒 XSE 205DU(瑞士):超速冷冻离心机:Sigma 3K30(德国);超纯水系统:Milliber Q S(美国)。
1.2 材料试剂基因组DNA提取试剂盒:天根生化DP323(中国);动物组织基因组DNA提取试剂盒:天根生化DP324(中国);PCR扩增试剂盒:ABI4369016(美国);数字PCR扩增试剂:Bio-Rad(美国);数字PCR扩增试剂:Fluidigm Biomark qdPCR 37KTM IFC(美国);甲醇(色谱纯)、乙醇(分析纯)、氢氧化钠(分析纯)。
1.3 基因组DNA提取及纯度分析采用商业化提取试剂盒的技术方案提取基因组DNA,采用紫外分光光度法对基因组DNA含量(OD260吸收值)和DNA纯度(OD260/OD280比值)进行了检测;另外,利用琼脂糖凝胶电泳方法对基因组DNA的完成性和相对含量进行了检测。
1.4 数字PCR方法通过文献及国家现行标准的比较分析[13-14],优化建立了虾过敏源标准物质的PCR扩增条件和引物探针体系,用优化建立的数字PCR扩增条件和反应体系对虾基因组DNA中目标基因片段,虾和胡萝卜基因组DNA中真核基因片段进行了定量扩增,用于标准物质特性量值的确定、均匀性检验、稳定性考察。
2 结果与讨论 2.1 基因组提取DNA纯化分析以商品化的基因组DNA提取试剂盒为基础,提取虾和胡萝卜的基因组DNA,利用紫外分光光度法和琼脂糖凝胶电泳法对纯化后的基因组DNA进行了纯度分析,结果见表1和图1。
| 样本名称 | 核酸浓度/
(ng∙μL–1) |
OD260 | OD280 | 260/280 |
| 虾 | 171.6 | 3.431 | 1.752 | 1.96 |
| 胡萝卜 | 55.3 | 1.106 | 0.606 | 1.83 |
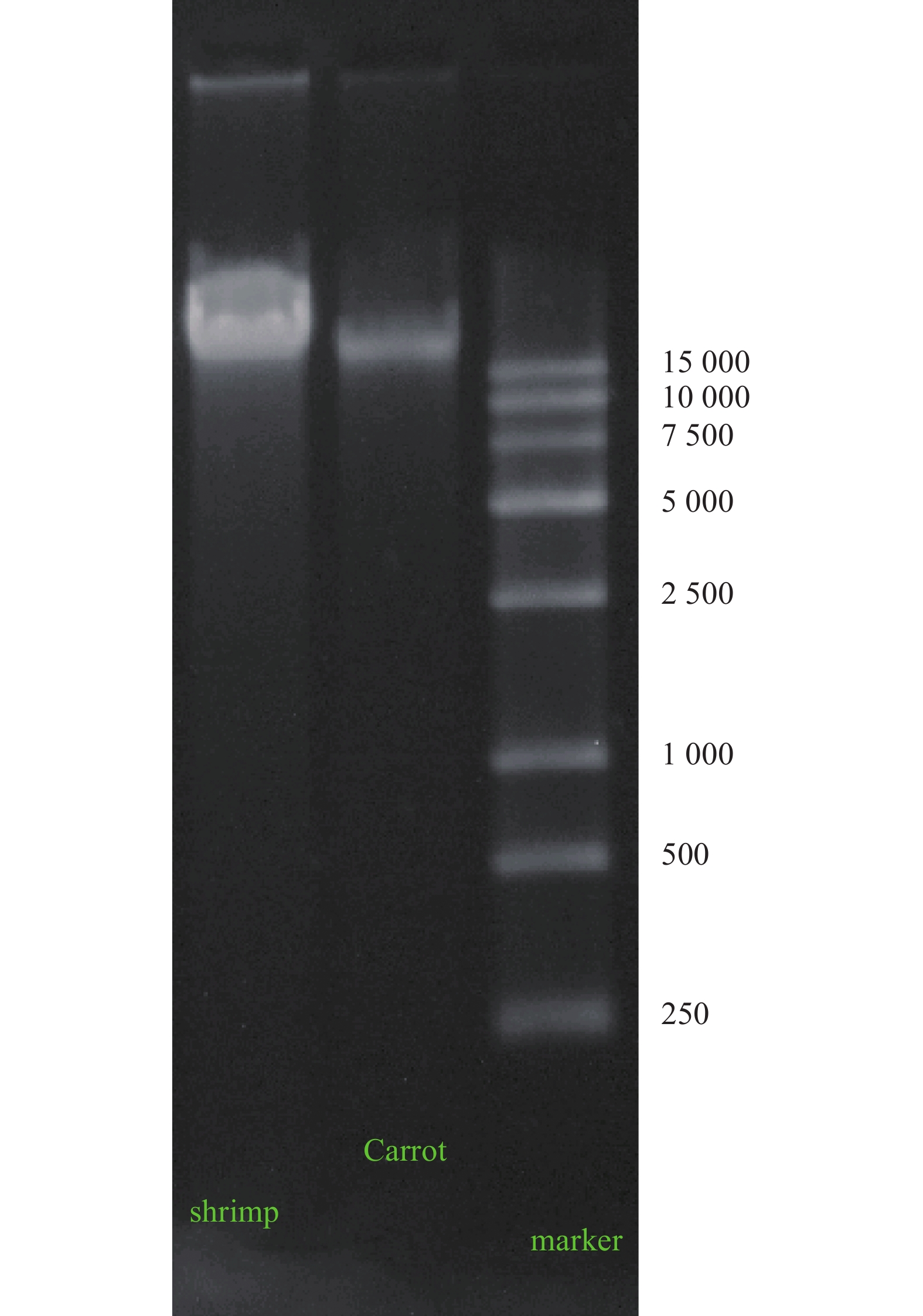
|
| 图 1 基因组DNA琼脂糖凝胶电泳法纯度分析 |
由表1可知,纯化后的基因组DNA OD260/ OD280介于1.8~2.0之间,样本纯度较高;由朗伯比尔定律可知,DNA浓度与OD260紫外吸收值成正比,OD260吸收值1对应于双链DNA 50 ng/μL。提取的基因组DNA用数字PCR进行检验,没有抑制效应,可以用于标准物质的定值分析。
分析图1可知,提取的基因组DNA纯度较高,蛋白质和RNA残留较少,满足了定量PCR和数字PCR检测的需要,可用于标准物质定值分析。
2.2 目标基因扩增条件通过文献及国家现行标准的比较分析最终确定了虾过敏源标准物质的PCR扩增条件和引物探针体系[13-14],PCR扩增热循环条件:50 ºC 2 min;95 ºC 变性、UNG酶失活10 min;95 ºC 变性15 s,60 °C 退火延伸1 min,50个循环。引物探针体系见表2,PCR反应体系为TaqMan Universal PCR Master Mix (2×) 10 μL;引物400 nmol/L,1 μL;探针400 nmol/L,1 μL;去离子水6 μL;DNA模板2 μL;总反应体系20 μL。
| 扩增序列名称 | 引物名称 | 引物序列(5'–3') |
| 真核生物18S (Euk18S) | Euk18S-F | TCTGCCCTATCAACTTTCGATGGTA |
| Euk18S-R | AATTTGCGCGCCTGCTGCCTTCCTT | |
| Euk18S-P | CCGTTTCTCAGGCTCCCTCTCCGGAATCGAACC | |
| 虾16S (shrimp16S) | shrimp-F | GATTAAGTTACTTTAGGGATAACAGCG |
| shrimp-R | TAAAGGTCGAACAGACCTTCTCAC | |
| shrimp-P | CTTCCTTGAAAGTTCATATCGACAGGAAGGG |
引物探针的特异性和灵敏度良好,热循环条件合适,可以有效扩增出目标基因条带。该反应条件可用于标准物质特性量值的定值确定和均匀性检验、稳定性考察。
2.3 标准物质均匀性检验均匀性是标准物质的固有特性之一,即在规定的细分范围内其特性保持不变。按照国家计量技术规范JJF 1343-2012《标准物质定值的通用原则及统计学原理》中对标准物质均匀性评估的技术要求,随机抽取15个包装单元,用数字PCR方法检测目标基因的拷贝数浓度进行标准物质均匀性检验。采用F检验法对均匀性测量数据进行了统计检验,结果见表3。由表可知研制的标准物质样品均匀一致,符合标准物质研制均匀性的要求。
| 标物名称 | 平均值 (copies∙μL−1) | 标准偏差 (copies∙μL−1) | F检验 | F (0.05) | 结果 |
| 1% 虾16S基因 | 332.73 | 6.27 | 1.43 | 2.31 | 均匀 |
2.4 标准物质稳定性考察
标准物质的稳定性是指在规定的时间间隔和环境条件下,标准物质的特性量值保持在规定范围内的性质。过敏源标准物质稳定性检验采用数字PCR方法进行测定。依据JJF1343-2012推荐的标准物质稳定性评价方法进行标准物质稳定性检验及评价,检验结果见表4, 分析可知在12个月时间内标准物质特性量值无显著性变化,符合标准物质的稳定性要求,检验结果为稳定。
| 项目 | 结果 |
| 物质 | 1%虾16S/真核生物18S |
| b1 | 0.24 |
| b0 | 333.42 |
| s2 | 5.13 |
| s(b1) | 2.26 |
| |b1| | 0.24 |
| t0.95,n−2·s(b1) | 1.67 |
| 稳定性 | |b1|<t0.95,n−2·s(b1),斜率不显著,未观察到不稳定性 |
2.5 标准物质的定值
基因组DNA采用本文建立的数字PCR方法进行目标基因拷贝数的绝对定量检测,确定了虾16S基因和真核生物18S基因,葫芦卜真核生物18S基因的拷贝数。依据JJF1343-2012 的要求和ISO导则34的要求,采用重量法配制过敏源基因组DNA标准物质,确定的标准值为拷贝数百分比值,为1%虾16S /真核生物18S=1%。
2.6 标准物质的定值不确定度分析定值结果不确定度主要从目标基因拷贝数数字PCR定量、标准物质的重量法配制、标准物质的不均匀性、标准物质的不稳定性等部分进行了考察。具体考察分析的不确定度来源鱼骨刺图见图2。
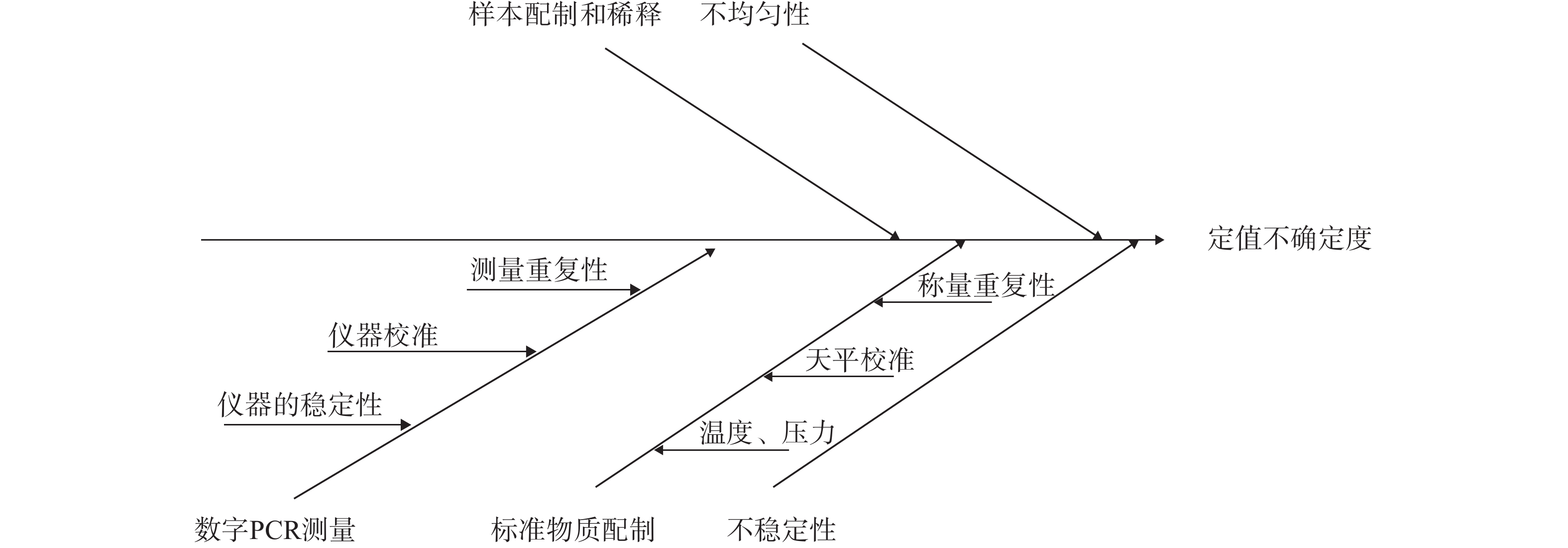
|
| 图 2 标准物质定值不确定度的来源分析 |
2.6.1 不确定度的量化
目标基因拷贝数数字PCR测量不确定度(uM)主要包括数字PCR校准、仪器稳定性、测量重复性3部分。仪器校准由校准证书得到,将其转化为相对标准物质不确定度计入标准物质特性量值的不确定度,仪器的稳定性和测量重复性由多次测量结果的相对标准偏差表示。标准物质重量法配制和样品的稀释配制产生的不确定度(uB)主要体现在天平称量方面,主要包含天平本身的不确定度和多次称量重复性两部分。不均匀性带来的不确定度(uH)和不稳定性带来的不确定度(uT)根据ISO导则35规定的计算方法进行计算。具体的量化结果见表5。
2.6.2 合成标准不确定度
以上不确定度分量互不相关,则合成标准不确定度为
| $ {{u = }}\sqrt {{{u}}_{\rm{M}}^2 + {{u}}_{\rm{B}}^2 + {{u}}_{\rm{H}}^2 + {{u}}_{\rm{T}}^2} $ |
虾过敏源标准物质合成标准不确定度为:u虾16S/真核18S=4.3%。
2.7 定值结果定值结果表示为:标准值±扩展不确定度。取包含因子k=2,则扩展不确定度可以表示为U=k×u。虾过敏源定值结果为1.01%±0.09%。
3 数字PCR验证将研制好的标准物质用数字PCR方法进行了特性量值验证,结果列于表6。
| 项目 | 虾16S拷贝数浓度
(copies∙μL−1) |
真核18S拷贝数
浓度(copies∙μL−1) |
虾16S/真核18S
拷贝数比值/% |
| 1 | 331 | 32 772 | 1.01 |
| 2 | 335 | 34 895 | 0.96 |
| 3 | 341 | 33 762 | 1.01 |
| 4 | 332 | 32 871 | 1.01 |
| 5 | 351 | 36 185 | 0.97 |
| 6 | 333 | 33 636 | 0.99 |
| 7 | 346 | 34 257 | 1.01 |
| 平均值 | − | − | 0.99 |
| SD | − | − | 0.02 |
| RSD | − | − | 2.16 |
由表中数据可知,数字PCR的测量值与重量法配制值能够很好的符合,由此说明,数字PCR进行目标基因拷贝数的精确定量,然后根据需要采用重量法配制成需要的不同目标基因比值的标准物质是可行的。由于数字PCR方法是不依赖于外标准的绝对定量方法,现在越来越多的应用到目标基因的定量分析中,也逐渐成为基于目标基因定量的核酸标准物质权威定量方法;而重量法可以很好的实现设定基因比率样本的配制,且选择精度良好的天平可以有效减少重量法配制给标准物质特性量值带来的不确定度影响;因此,数字PCR和重量法结合很好的实现了不同物种间不同目标基因检测标准物质特性量值的确定,且准确度较高。
4 结束语针对过敏源检测急需的目标基因检测标准物质稀缺问题,本文研究建立了基于数字PCR技术的目标基因拷贝数浓度确定方法,测定了虾16S基因和真核生物18S基因,葫芦卜真核生物18 s基因的拷贝数,然后利用重量法配制了虾16S基因/真核生物18S基因DNA配比标准物质;评定了定值结果的不确定度,为基于目标基因检测的过敏源标准物质的研制提供了方法借鉴。
| [1] |
EHLERT A, HUPFER C, BUSCH U. Overview of detection methods of allergens in foods. Fleischwirtschaft, 2008, 88(1): 89-91.
|
| [2] |
周煌, 杨安树, 佟平, 等. 食物过敏源标准物质的研究进展[J].
食品工业科技, 2012, 33(23): 438-442.
|
| [3] |
龚方, 房保海. 国内外食品过敏原标签管理现状与趋势[J].
食品安全质量检测学报, 2012, 3(3): 226-230.
|
| [4] |
OLIVER S, STEFAN V. Development of a real-time PCR and a sandwich ELISA for detection of potentially allergenic trace amounts of peanut (arachis hypogaea) in processed foods[J].
Journal of Agricultural and Food Chemistry, 2004, 52(12): 3754-3760.
DOI:10.1021/jf035178u |
| [5] |
王玮, 韩建勋, 袁飞, 等. 多重PCR同时检测常见8种食物过敏原[J].
中国食品学报, 2011, 11(6): 152-157.
DOI:10.3969/j.issn.1009-7848.2011.06.023 |
| [6] |
SIEGEL M, MUTSCHLER A, BOERNSEN B, et al. Food matrix standards for the quantification of allergenic food ingredients using real-time PCR[J].
European food research and technology, 2013, 237(2): 185-197.
DOI:10.1007/s00217-013-1978-x |
| [7] |
韩远龙, 吴志华, 闫飞, 等. 花生过敏原检测方法研究进展[J].
食品科学, 2012, 33(13): 305-308.
|
| [8] |
CHO C Y, NOWATZKE W, OLIVER K, et al. Multiplex detection of food allergens and gluten[J].
Analytical and bioanalytical chemistry, 2015, 407(14): 4195-4206.
DOI:10.1007/s00216-015-8645-y |
| [9] |
ELISA I, ANA J, NURIA P, et al. Real Time PCR to detect hazelnut allergen coding sequences in processed foods[J].
Food Chemistry, 2013, 138(2/3): 1976-1981.
|
| [10] |
梁君妮, 孙敏. 实时荧光PCR法检测食物中榛子过敏原成分[J].
食品工业科技, 2011(1): 293-295.
|
| [11] |
陈家杰, 王海燕, 梁秋妮, 等. 两种PCR方法检食品中花生过敏原Arah1成分[J].
食品研究与开发, 2011, 32(9): 69-74.
DOI:10.3969/j.issn.1005-6521.2011.09.021 |
| [12] |
FUTOSHI A, TAKANE O. PCR-based detection of allergenic mackerel ingredients in seafood[J].
Journal of genetics, 2004, 83(2): 193-195.
DOI:10.1007/BF02729897 |
| [13] |
出口食品中过敏原成分检测方法 第10部分 实时荧光PCR方法检测虾蟹成分: SNT 1961.10-2013 [S]. 北京: 中国质检出版社, 2013.
|
| [14] |
出口食品中过敏原成分检测方法 第7部分 实时荧光PCR方法检测胡萝卜成分: SNT 1961.7-2013 [S]. 北京: 中国质检出版社, 2013.
|
 2019, Vol. 45
2019, Vol. 45


 ,
,