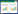文章信息
- 谭和平, 孙嗣旸, 李怀平, 冯徳建, 史谢飞, 吴媛媛
- TAN He-ping, SUN Si-yang, LI Huai-ping, FENG De-jian, SHI Xie-fei, WU Yuan-yuan
- 植物药材农药残留药典标准分析研究
- Research on standard system of pesticide residues in phytomedicine
- 中国测试, 2014, 40(1): 55-58
- CHINA MEASUREMENT & TEST, 2014, 40(1): 55-58
- http://dx.doi.org/10.11857/j.issn.1674-5124.2014.01.015
-
文章历史
- 收稿日期: 2013-10-13
- 收到修改稿日期: 2013-11-21
植物药材源至天然,毒副作用小,不仅在中国、日本等传统中医药大国被广泛使用,而且欧洲、美国等发达国家的《国家药典》也开始大量收载植物药材。全球对植物药材的研究开发及其产业化成为热点,为我国植物药材产业发展提供了前所未有的机遇和挑战,也为我国植物药材及制品的出口带来了广阔的市场空间。然而,随着植物药材从野生到人工种植,农药的不合理使用致使我国植物药材农药残留形势严峻,由农药残留超标引起植物药出口的不良事件屡有发生,严重影响了我国中医药大国的良好声誉,且制约了我国植物药材及其制品的出口创汇。如2002年韩国从水参中检出杀虫剂超过相关标准7倍以上,随即韩国主管部门对中国水参做出了不适宜进口的决定;2007年我国出口美国的枸杞因农残超标被美国食品药品管理局拒绝入境;截至2009年,我国出口德国的植物药因农残和重金属超标而被退回的达30%以上;同样,在1995~2006年间,我国出口澳大利亚的植物药有30%因农残超标被就地销毁[1, 2, 3]。为此,本文系统分析了我国与国外主要发达国家药典标准在涉及植物药材农药残留限量及检测技术的相关规定,研究了我国药典标准在农药残留规定方面的不足,以期完善我国药典标准提供依据和参考,提升我国植物药材及其制品的核心竞争力和市场占有率,推动我国植物药材产业可持续健康发展。
1 分析与讨论 1.1 《中国药典》与各国药典农药残留限量的对比分析2012年10月25日,国家药典委员会在2010年版《中国药典》的基础上,发布了有关农药残留的限量标准草案[4, 5],共涉及9种农药(部分以总和统计),这是我国药典首次对所有药材规定农药残留限量标准,见表 1。此前,2005年版《中国药典》仅对甘草和黄芪中六六六、滴滴涕和五氯硝基苯制定了限量标准。另外,WM/T2-2004《中国药用植物及制剂外经贸绿色行业标准》是《中国药典》之外另一项涉及到植物药材农药残留限量的标准[6],但该标准仅规定了4种农药(部分以总和统计)的限量。由表 1可知,国内限制植物药材中农药残留种类偏少,且涉及的农药1/3为禁用农药,诸如百草枯、苯醚甲环唑、嘧菌酯等多种植物药材登记用药尚缺乏限量标准,且实际生产中农药滥用现象也十分普遍,可见,我国药典标准已经远远落后于生产,难以起到有效指导生产和监督管理的作用。另外,两项法规对同一种农药的限量不一致,原因是《中国药典》是由卫生部发布的,其主要目的在于保障消费者的健康安全,而WM/T2-2004《中国药用植物及制剂外经贸绿色行业标准》是由商务部发布,目的在于促进公平贸易。二者制定侧重点不一致,造成了限量标准的不一致,不利于我国植物药材及其制品卫生质量标准的规范和执行。
相对而言,发达国家药典的制定过程更为科学严谨,以《欧洲药典》对植物药分类为例[8],分类依据是按加工过程进行界定:第1种是植物药,指未经任何加工的植物、藻类、真菌和苔藓类的全部或部分,仅有干燥和新鲜之分,此外,一些未经特殊处理的植物分泌物也被认为是植物药。第2种是植物药原料,指植物药经过提取、蒸馏、压榨、分离、纯化、浓缩或发酵等方式处理所获得的药剂,包括粉碎或粉末状的植物药、提取物和经过加工的分泌物等。第3种是植物药产品,指任何一种或几种植物药(植物药原料)的组合、并制成具有活性成分的成品。对分类后的3种植物药分别制定卫生质量标准,可以有效避免加工过程对植物药有效成分或外源添加剂产生干扰。
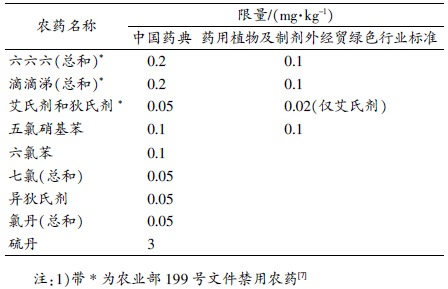
《欧洲药典》和《美国药典》是当前世界上涉及植物药农药残留限量最多的药典[9],共76种农药(部分以总和统计),而且各种农药之间的限量值差别很大,见表 2,体现了在制定植物药卫生限量标准时的严谨性和科学性。造成差别的原因在于制定药典过程中对每种农药的特性做了详细分析:首先是农药对植物形成有效保护的最小使用量;其次是人体每日最大允许摄入量;再者考虑环境可承载量。综合以上3方面,对不同农药限量进行研究,最终制定出合理的限量标准。在亚洲主要的植物药大国中,《韩国药典》中涉及的限制农药数量较多[10],而且多集中在常用的有机磷农药上,相对于部分高毒或禁用的有机氯农药而言,关注有机磷农药更符合当前植物药材的种植和使用环境,另外《韩国药典》还规定了27种农药在一些常见植物药中的限量,也进一步体现了其药典的实用性。《日本药典》中涉及植物药材的农药种类偏少[11],只对几种有机磷农药做了限量,但考虑到一些植物药属于药食同源的情况,可能需要参考更为严格的《日本食品中残留农业化学品肯定列表制度》,所以从食品安全角度来看,日本对植物药农药残留的限量也非常严格。《英国药典》只对植物药中的农药进行了概括性限制:每1 kg植物药中有机氯农药的限制为0.05 mg,其他农药为0.5 mg或1.0 mg[12],尽管限定方法较为粗略,但区分了有机氯类农药和其他农药。
通过表 2对比可知,我国植物药卫生质量标准与发达国家还有一定差距,表现为限制农药的数量太少,且主要集中在有机氯农药,虽然限量值与发达国家基本一致,但受限的几种农药都是广受关注的高毒或禁用农药,说明我国植物药材农药残留限量标准尚处于起步阶段,仅对全球关注的几种有机氯农药做出了与发达国家基本一致的限量标准,缺乏针对性和实效性。因此,限制国内植物药材登记使用农药的用量并参考国际关注的农药种类,才能有效规范我国植物药材的农药使用,保证出口质量安全,进而跟上国际植物药材的发展形式。此外,相比我国不同部门制定不同标准而言,《欧洲药典》农药残留限量标准的制定理念更值得我们借鉴,即将人的最大允许摄入量、植物的最小保护量和环境问题综合考虑,制定统一、合理的植物药材农药限量标准。另外,《韩国药典》对一些常用农药在常见植物药中进行限量也有一定参考价值,这一方法类似于各国食品法规的限制方法,限制标准更加细化,而且重视了不同农药对植物药有效成分的影响。
1.2 《中国药典》与各国药典农药残留检测方法的对比分析气相色谱法是农药残留测定最为常见的分析方法,各国药典也都以气相色谱配备不同的检测器作为标准检测方法,见表 3。目前,常见的检测器有电子捕获检测器(ECD)、氢火焰检测器(FID)、氮磷检测器(NPD)、火焰光度检测器(FPD)以及近年发展起来的质谱(MS)和串联质谱检测器(MS/MS)等。传统液相色谱测定农药残留量的方法仅是气相色谱方法的补充,主要分析对象为极性大、沸点高、相对分子质量大或是热不稳定的少数农药品种。
由表 3可知,《中国药典》和其他药典检测方法最大的区别在于提取和净化方法。在提取方法中,《中国药典》对有机氯类农药、有机磷类农药和拟除虫菊酯类农药进行分别提取,其他药典对3种农药都采取统一的提取方法,这一差别有待通过大量实验数据进行分析,对比测定结果及回收率等指标是否有显著性差异,进而确定是否有必要将《中国药典》提取方法统一并与国际接轨。在净化方法中,《中国药典》对有机氯类农药采用的是磺化法,这一方法更适用于酸性条件下稳定的农药,如六六六、艾氏剂等,如果所有有机氯类农药都采用磺化法净化必定会对测定结果造成影响,因此测定过程中的净化方法有待改进。近年来,质谱以及串联质谱技术的应用,使得农药残留分析迈入了多种类、多组分的高通量定性筛查和精确定量时代,具有定性准确、排除干扰能力强以及灵敏度高等显著特点,以质谱技术作为检测手段的农药残留分析方法已成为农药多残留分析的主导技术和未来发展的趋势。因此,我国药典标准也应该建立以质谱技术为检测手段的农药残留检测标准方法,推动我国植物药材农药残留检测紧跟时代步伐。
2 结束语我国植物药材农药残留药典标准存在较大漏洞。由于药典标准的落后,难以推进中药材现代化和国际化进程,严重影响我国植物药材参与国际市场的竞争力,同时制约我国植物药材产业的可持续健康发展。加之我国植物药材农药残留限量缺乏统一的标准,势必会造成农药在植物药材种植过程中的不合理使用,无法有效规范我国植物药材卫生质量。因此,尽快完善统一我国植物药材农药残留限量标准势在必行。
| [1] | 王莹. 中药中GC-MS农药多残留法检测平台的建立[D]. 北京:中国药品生物制品研究所,2011. |
| [2] | 金红宇,王莹,孙磊,等. 中药中外源性有害残留物监控的现状与建议[J]. 中国药事,2009,23(7):639-642. |
| [3] | 徐世文. 2003年度我国主要贸易伙伴技术壁垒、卫生与植物卫生措施实施情况回顾[J]. 口岸卫生控制,2003,10(5):14. |
| [4] | 国家药典委员会. 中华人民共和国药典(1部)[S]. 北京: 中国医药科技出版社,2010,附录57. |
| [5] | 关于中药中重金属、农残、黄曲霉毒素等物质限量标准草案的公示[DB/OL]. |
| [6] | WM/T2—2004药用植物及制剂外经贸绿色行业标准[S]. 北京:中国标出版社,2005. |
| [7] | 中华人民共和国农业部. 中华人民共和国农业部公告第199号[R]. 农药登记公告,2002. |
| [8] | Europe pharmacopoeia 7th edition[S]. European Directorate for Quality Medicines,2010. |
| [9] | The united states pharmacopoeia 34th Edition[S]. The United States Pharmacopeial Convention,2011. |
| [10] | The Korea pharmacopoeia 8th revision[S]. The Japanede Pharmacopoeia Commission,2002. |
| [11] | Japan pharmacopoeia 16th revision[S]. The Japanede Pharmacopoeia Commission,2011. |
| [12] | British pharmacopoeia 2012[S]. British Pharmacopoeia Commission,2012. |
| [13] | Quality Control Procedures for Pesticide Residues Analysis Document No. SANCO/10232/2006 24/March/2006[S]. European Union Commission,2006. |
 2014, Vol. 40
2014, Vol. 40